寨卡病毒是一类蚊媒传播病原,感染孕妇可引起新生儿小头畸形。2015-16年寨卡疫情成为国际公共卫生紧急事件,目前尚无获批疫苗。寨卡病毒与登革病毒的抗原性接近,属一个超血清家族。最新的人群队列研究发现,既往的寨卡病毒感染能够显著增加后续登革病毒感染的严重程度,证明寨卡预存抗体对登革病毒感染有严重的抗体依赖增强(ADE)风险(Science, 369, 1123–1128 (2020))。寨卡/登革血清型之间的ADE是疫苗研制亟需解决的焦点安全问题,特别是这两类病毒可由相同的媒介(比如埃及伊蚊)传播,且流行区域重叠。因此,理想的寨卡疫苗应该具备以下3个特点:1)预防寨卡病毒的母婴传播;2)预防由于寨卡病毒感染引起的登革ADE;3)预防由于寨卡疫苗免疫导致的登革ADE。而现全球进入临床阶段的寨卡疫苗在设计上都没有避免潜在的登革ADE风险。

2021年7月15日,中国科学院微生物研究所高福、戴连攀、严景华等在Nature Immunology 在线发表了题为Protective Zika vaccines engineered to eliminate enhancement of dengue infection via immunodominance switch的研究论文,提出了消除了登革ADE的保护性寨卡疫苗新策略。
寨卡/登革病毒引起ADE效应的交叉抗体主要靶向病毒表面结构蛋白prM和E蛋白的融合肽(FL)保守区域(Science 328, 745–748 (2010))。国际上有报道通过在FL表位引入突变或者构建E蛋白二聚体遮蔽FL表位的两种方式,可显著降低寨卡疫苗对登革病毒感染的ADE。然而,在小鼠模型上这两种疫苗方式都不能产生足够的保护性免疫应答,完全阻断寨卡病毒母婴垂直传播(Cell 168, 1114–1125 e1110 (2017), Nat. Immunol. 20, 1291–1298 (2019))。鉴于寨卡病毒感染孕妇对新生儿潜在的长期严重后果,能诱导母婴清除性免疫应答(sterilizing immunity)的寨卡疫苗尤为重要。
高福院士团队从2016年起便开展针对寨卡病毒的研究,解析出寨卡病毒保护性免疫原E蛋白的晶体结构,并分离到了一系列靶向E蛋白不同结构域的中和/保护抗体,解析了靶向FL表位的代表性ADE抗体的结构基础 (Cell Host Microbe 19, 696–704(2016);Sci. Transl. Med. 8, 369ra179(2016))。这些前期基础为理性设计消除ADE的寨卡疫苗提供了重要的指导。
在本项研究中,研究者采取了一种抗体指导疫苗设计的反向疫苗学策略。基于ADE抗体结合FL的结构基础(图1),对寨卡免疫原E蛋白进行理性改造,旨在既消除FL表位,又能维持其他中和抗体表位的完整。由于FL区在黄病毒属中高度保守,在FL表位的关键氨基酸上引入突变很容易破坏E蛋白结构,极大的降低疫苗的免疫原性。因此,研究者通过同源替换的方法,将寨卡E蛋白的FL替换成黄病毒属中进化关系最远的昆虫特异性(arthropod-specific)黄病毒的同源序列,从而改变了FL表位上结合ADE抗体的3个关键氨基酸。进一步通过一系列中和保护性抗体和ADE抗体对改造后E蛋白抗原进行正向和负向筛选,获得同时满足FL表位消除和中和表位维持的构建。其中2种设计MutB和MutC被制备成黑猩猩腺病毒载体(AdC7)疫苗进行评估。

图1. 基于靶向FL表位的ADE抗体结构指导抗原理性设计
结果显示,MutB/C疫苗一次免疫可产生清除性的免疫应答, 完全保护小鼠抵御寨卡病毒攻毒, 在病毒感染的所有靶组织中都检测不到病毒载量。此外,在孕鼠感染模型中显示疫苗完全阻断寨卡病毒的母婴传播,在胎鼠的鼠脑和胎盘中都检测不到病毒载量(图2)。

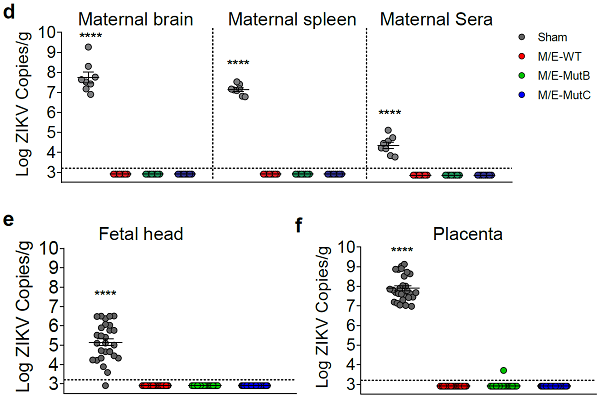
图2. MutB/C疫苗阻断寨卡病毒的母婴传播
研究者进一步通过体外和体内试验验证MutB/C对登革病毒感染的ADE。令人振奋的是,MutB/C疫苗免疫血清完全消除了对四种血清型登革病毒的ADE;血清过继试验证实MutB/C疫苗免疫血清不会引起登革病毒感染的ADE,而野生型构建(WT)则引起会加快动物的死亡和病症加重(图3)。
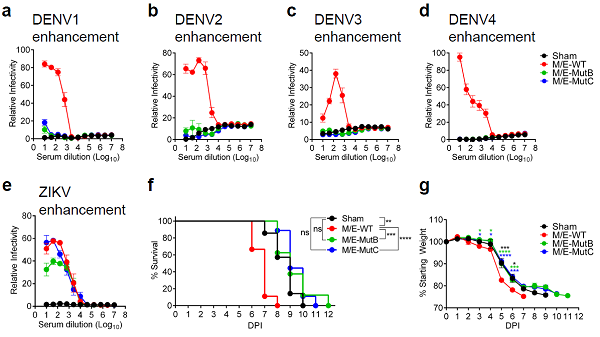

图3. MutB/C疫苗消除了对登革病毒感染的体外和体内ADE
为了进一步探究改造后疫苗MutB/C消除ADE的免疫学基础,研究者们通过B细胞受体(BCR)的单细胞测序方法分析了免疫后小鼠淋巴结的抗原特异性BCR的特性。结果显示,野生型疫苗激发的体液免疫存在明显的免疫优势情况,60%以上的BCR使用3组胚系基因。而MutB/C打破了原有的免疫优势,使抗原特异性BCR使用的胚系基因呈分散式分布(图4)。研究者又以抗体IgG的形式合成了各免疫组中代表性的优势抗体。研究发现野生型疫苗诱导的优势抗体都靶向FL表位,且对四种血清型的登革病毒存在交叉结合和显著的ADE。而MutB/C疫苗诱导的优势抗体几乎不结合各血清型登革病毒,且无ADE。有趣的是,通过对现有报道不同来源黄病毒FL表位鼠单抗的比较发现,这些抗体都使用了和本文报导的野生型疫苗激发出来抗体几乎同样的胚系基因。这提示,黄病毒FL表位的ADE抗体可能共用着少数几个相似胚系基因。
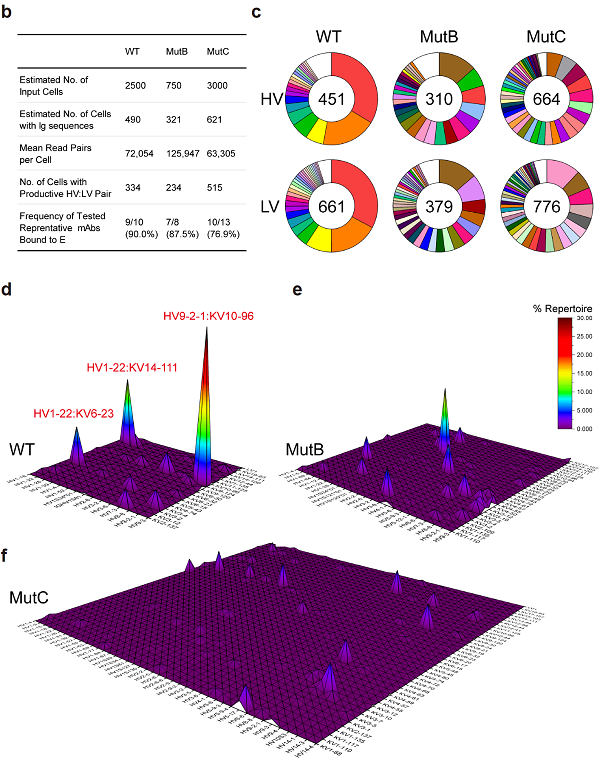
图4. MutB/C疫苗转换了由ADE抗体占据的免疫优势
研究者们最后解析了其中一个抗原改造E蛋白MutC结合中和抗体的分子基础,发现MutC仍然能够通过新的作用力维持E蛋白的二聚体结构,这对于激活有效中和抗体非常重要。此外,改造后的FL氨基酸产生对ADE抗体的位阻和电荷排斥,因此揭示了MutC不诱导ADE抗体产生的结构基础。
该研究成功应用结构指导抗原设计用于解决寨卡疫苗ADE问题,为寨卡疫苗开发中长期存在的问题提供了一个漂亮的解决方案。理性设计消除ADE的新型寨卡疫苗朝着开发安全有效寨卡疫苗迈出了一大步,并将指导寨卡疫苗未来在临床使用。
中国科学院微生物研究所高福院士、戴连攀研究员和严景华研究员为该论文的共同通讯作者。戴连攀研究员、海南医学院徐坤博士和中国科学院北京生命科学研究院博士生李金和为论文并列第一作者。海南医学院夏乾峰教授等给予了重要帮助。




