近日,中国科学院微生物研究所王硕团队在《细胞和分子免疫学》(Cellular & Molecular Immunology)发表了题为“Antigen-presenting innate lymphoid cells induced by BCG vaccination promote a respiratory antiviral immune response through the skin‒lung axis”的研究论文。该研究发现皮下接种结核病疫苗卡介苗(BCG)能够诱导I型固有淋巴细胞(ILC1)产生抗原递呈功能,揭示了ILC1通过皮肤-肺轴迁移促进肺部抗病毒感染的免疫应答的调控机制。
卡介苗(BCG)具有广泛的异源保护作用,然而,BCG接种途径与非特异性免疫保护机制的产生之间的关系尚不清楚。I型固有淋巴细胞(ILC1)是一类在抗感染过程中发挥重要作用的固有淋巴细胞。王硕团队研究发现皮下接种BCG可增加肺中ILC1数量,诱导ILC1表达MHCII等抗原递呈相关分子。在肺部流感病毒H1N1感染过程中,MHCII+ ILC1能够发挥抗原递呈功能,促进CD4+ T细胞特别是辅助性T细胞(Th1)的数量和功能,促进流感病毒的清除。研究团队进一步分离了ILC1呈递的多肽-MHCII复合物(pMHCII),鉴定了ILC1表达的MHCII分子呈递的流感病毒肽段,并且验证了MHCII+ ILC1递呈流感病毒PB1抗原并激活CD4+ T细胞的功能。
通过光转化小鼠模型,研究团队发现皮下BCG免疫能够诱导MHCII+ ILC1的皮肤-肺轴迁移,并产生抵御肺部流感感染的保护作用 。通过机制研究发现BCG及其成分均可通过激活TLR2信号通路诱导ILC1表达 MHCII分子和皮肤-肺轴迁移。综上,本项研究揭示了皮下免疫BCG可以通过皮肤-肺轴诱导肺部免疫应答的调控机制,有助于更好地了解疫苗免疫的机制,促进黏膜相关疫苗的开发。
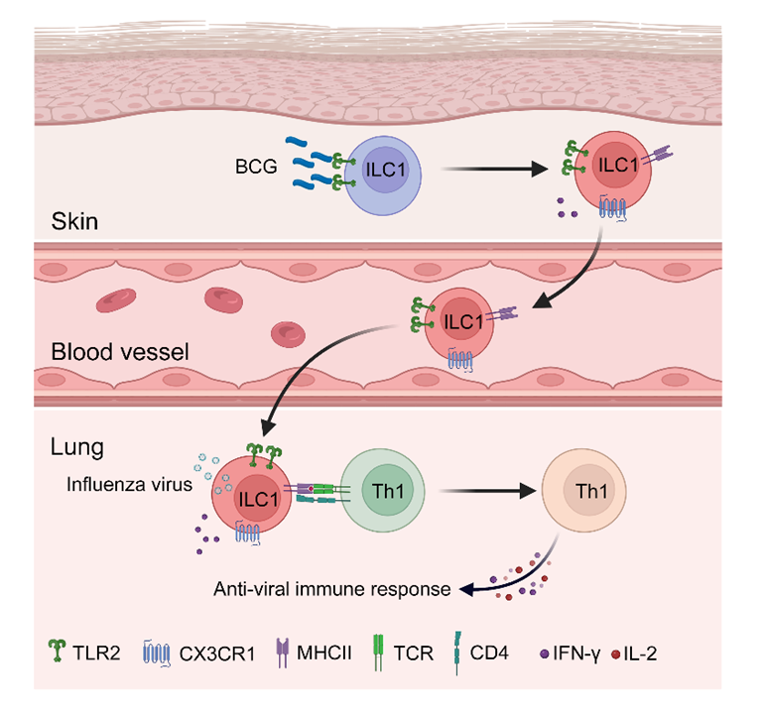
图1. BCG诱导的ILC1通过皮肤-肺轴激活肺部Th1细胞发挥抗感功能
中国科学院微生物研究所博士研究生於逗为本文第一作者,微生物所王硕研究员为本文通讯作者。本研究得到了中国科学院微生物所刘翠华研究员和北京大学夏朋延研究员的支持与帮助。研究获得国家重点研发计划、北京市自然科学基金和中国科学院稳定支持基础研究领域青年团队计划等项目资助。
论文链接:https://doi.org/10.1038/s41423-025-01267-w




