近日,中国科学院微生物研究所刘翠华团队揭示了结核分枝杆菌(M. tuberculosis,Mtb)效应蛋白Mce3C通过重塑宿主细胞死亡程序进而促进病原感染与致病的新机制(图1),相关研究以“A bacterial effector manipulates host lysosomal protease activity-dependent plasticity in cell death modalities to facilitate infection”为题发表在《美国国家科学院院刊》(PNAS)上。
不同的程序性细胞死亡信号通路之间存在密切联系,在响应病原感染过程中可通过相互调节以确保宿主启动最佳的炎症免疫应答。然而,病原菌如何重塑宿主的细胞死亡程序,进而导致宿主炎症免疫损伤并促进感染的机制研究尚浅。
结核病(tuberculosis,TB)是由Mtb引起的一种重大慢性传染病,目前已重新成为全球由感染导致死亡的首要原因。TB患者常伴随肺组织的炎性损伤与干酪样坏死,主要原因在于Mtb能够诱导宿主细胞发生炎症性坏死。该研究发现,在感染过程中,Mtb的效应蛋白Mce3C能够与宿主溶酶体释放的组织蛋白酶B(cathepsin B,CTSB)直接结合,进而抑制其对细胞死亡相关底物蛋白BID和RIPK1的剪切。在宿主细胞中,CTSB是调控宿主细胞死亡程序的关键分子节点:一方面,CTSB剪切BID将产生可促进凋亡(apoptosis)的tBID活性片段;另一方面,CTSB剪切RIPK1则将使其失去全长分子才具备的促进坏死性凋亡(necroptosis)的活性。因此,Mce3C介导的CTSB酶活抑制能够抑制宿主细胞凋亡并转而促进细胞发生坏死性凋亡。在小鼠感染模型中,当Mtb Mce3C与宿主CTSB互作区段缺失或突变时,宿主肺组织中被感染的细胞发生凋亡的比例显著上升,而发生坏死性凋亡的比例显著下降,同时伴随着细菌载量的减少与肺组织炎症损伤的减轻。
该研究发现了Mtb调控宿主细胞死亡模式间转换的关键病原效应蛋白Mce3C,揭示了其通过靶向溶酶体蛋白酶调控宿主细胞死亡程序的新机制,提供了靶向Mtb Mce3C-宿主CTSB互作界面以减轻宿主病理性炎症免疫损伤并抑制病原感染的TB防治新策略。
中国科学院微生物研究所博士研究生陆喆为该论文的第一作者,刘翠华研究员和柴琪瑶项目研究员为论文共同通讯作者。该研究得到国家重点研发计划等项目的资助。
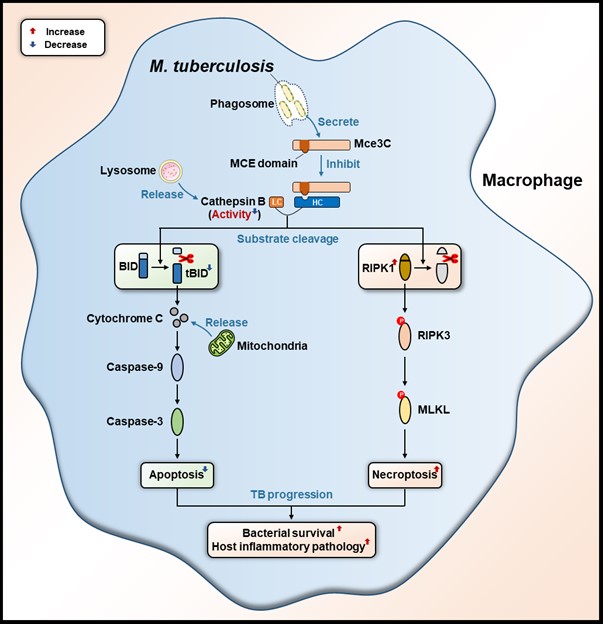
图1. Mtb Mce3C靶向宿主cathepsin B重塑宿主细胞死亡程序进而促进病原致病
文章链接:https://doi.org/10.1073/pnas.2406715122




