2024年8月21日,中国科学院微生物研究所高福团队在Nucleic Acids Research 在线发表了题为Structural basis for difunctional mechanism of m-AMSA against African swine fever virus 的研究论文。该研究解析了非洲猪瘟病毒(ASFV)II型DNA拓扑异构酶(Topo II)pP1192R介导DNA拓扑结构改变的分子机制,揭示了pP1192R这一唯一已知的哺乳动物病毒Topo II的抑制剂偏好性和全新的抑制剂作用机理,并提供了详细的药物靶点信息。该研究为ASFV复制机制的解析奠定了基础,并为开发针对ASFV复制阶段的抗病毒药物提供了新思路。
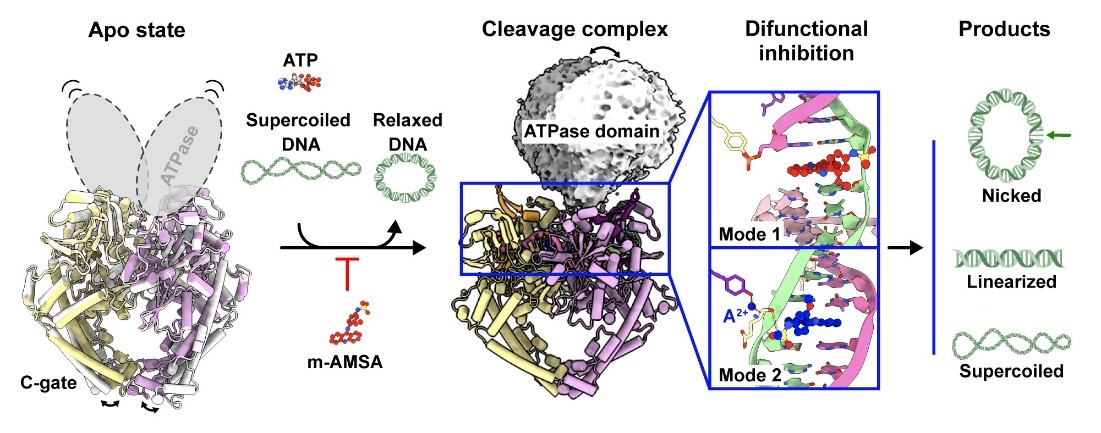
图1. 图形摘要
DNA拓扑异构酶在DNA复制、转录、重组和修复等核心生命过程中起着关键作用,通过引入单链或双链断裂解开DNA的超螺旋结构,促进这些过程的精确进行。ASFV的II型DNA拓扑异构酶pP1192R在病毒感染的中晚期阶段高度活跃,是病毒复制的关键酶。
团队利用多种结构生物学手段,解析了pP1192R全酶活周期中多个酶活阶段的分子构象。在全面评估了Topo II抑制剂对pP1192R的靶向性后,发现仅真核Topo II抑制剂m-AMSA特异性阻断pP1192R的酶活功能,并显著抑制ASFV在猪肺泡巨噬细胞(PAM)中的复制。随后,研究团队解析了pP1192R-DNA-m-AMSA三元复合物结构,从生化和结构两个角度揭示了m-AMSA对pP1192R的双重抑制机制。除通过传统的捕获Top II-DNA共价复合物的机制抑制酶活功能外,研究首次发现Topo II抑制剂可以通过阻止DNA断裂并稳定非共价的Topo II-DNA复合物的机制抑制Topo II的酶活功能。此外,通过解析pP1192R对DNA的预切割状态构象,研究首次发现了桥接Topo II DNA酶切活性氨基酸和DNA磷酸骨架间的金属离子(A2+)。这一发现为Topo II的双离子依赖的DNA切割机制提供了直接证据。
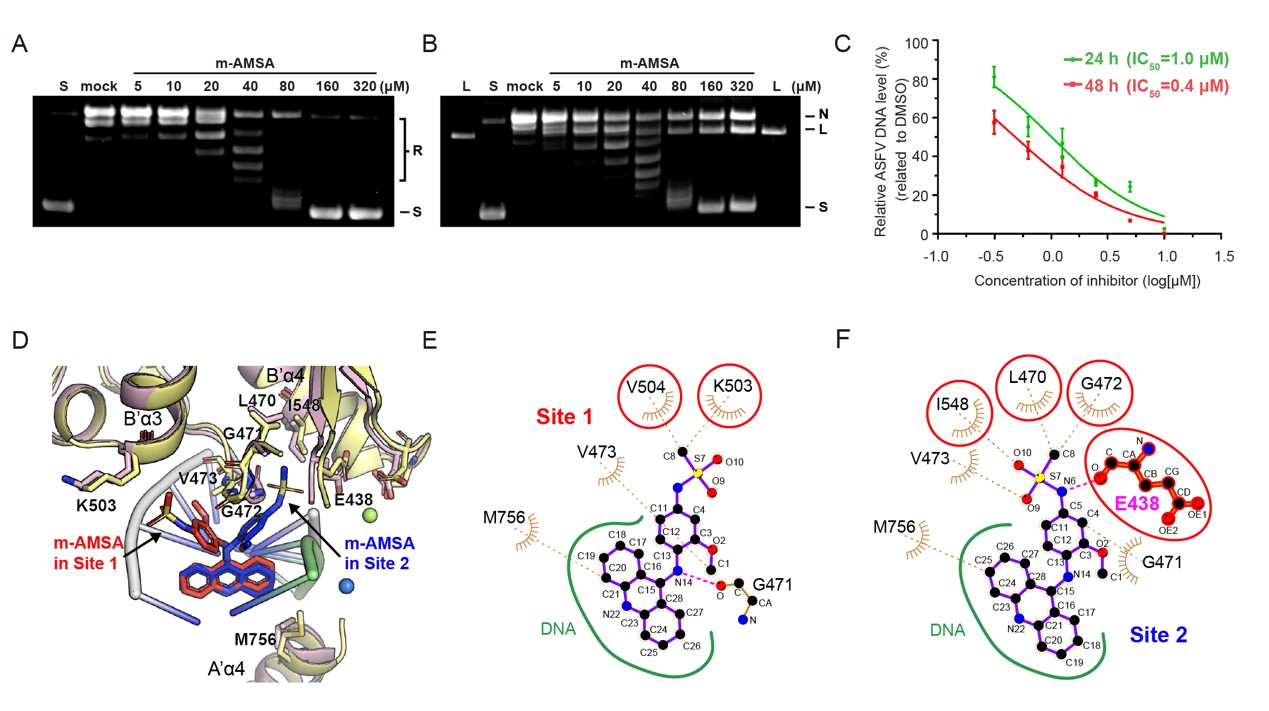
图2. m-AMSA抑制pP1192R的分子机制
中国科学院微生物研究所高福院士、齐建勋研究员和北京大学未来技术学院王寒副研究员为论文的共同通讯作者。河南农业大学博士研究生刘瑞丽、程英显,山西农业大学博士研究生孙俊清和中国农业科学院哈尔滨兽医研究所李连峰副研究员为论文的共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金和北京大学学科建设经费的资金支持。
原文链接:https://doi.org/10.1093/nar/gkae703




