2024年7月29日,中国科学院微生物研究所研究团队与福建师范大学合作在Nature Chemical Biology在线发表了题为“CRISPR-repressed toxin–antitoxin provides herd immunity against anti-CRISPR elements”的研究论文。该研究阐释了一种不基于序列识别的群体免疫机制,拓展了对CRISPR免疫策略的理解。
CRISPR-Cas系统是存在于细菌和古菌中的一种适应性免疫系统,能够通过特异性识别噬菌体等外源遗传元件的DNA序列产生靶向免疫,但它也频繁遭受anti-CRISPR元件的破坏,目前已发现上百种anti-CRISPR蛋白家族和RNA-based anti-CRISPR(Racr)元件。这些高度多样且在MGE中普遍存在的anti-CRISPR蛋白或RNA元件,给细菌的CRISPR免疫防线带来巨大挑战。
团队基于前期对于CRISPR护卫系统的原创发现(Science.372(6541):eabe5601),进一步研究表明,当CRISPR-Cas系统遭到任何anti-CRISPR元件(无论蛋白或RNA)破坏时,CRISPR护卫系统中原本被抑制的毒素基因会被释放表达,导致菌体生长停滞和流产感染,表现出一种广谱的anti-anti-CRISPR作用。这种被CRISPR抑制调控的毒素非常多样化,在本研究中是一种来自于噬菌体的KilA同源蛋白,被CRISPR系统“征用”来诱导菌体无法正常分裂乃至死亡。此外,团队利用这一广谱anti-anti-CRISPR分子回路,开发了一套高效的anti-CRISPR筛选体系,并成功筛选到了两类通过不同机制抑制Cas蛋白特异性识别能力的新型Acr蛋白,或为基因编辑工具的精准调控提供新元件和开发思路。
中国科学院微生物研究所特别研究助理舒宪、副研究员王锐、博士研究生李志华和特别研究助理薛琼为该论文的共同第一作者,微生物所李明研究员、李洁研究员、王锐副研究员和福建师范大学欧阳松应教授为该论文的共同通讯作者。该研究得到了科技基础资源调查专项、国家自然科学基金、国家重点研发计划、中国科学院青年创新促进会、国家博士后创新人才资助计划和中国博士后科学基金等项目的支持。
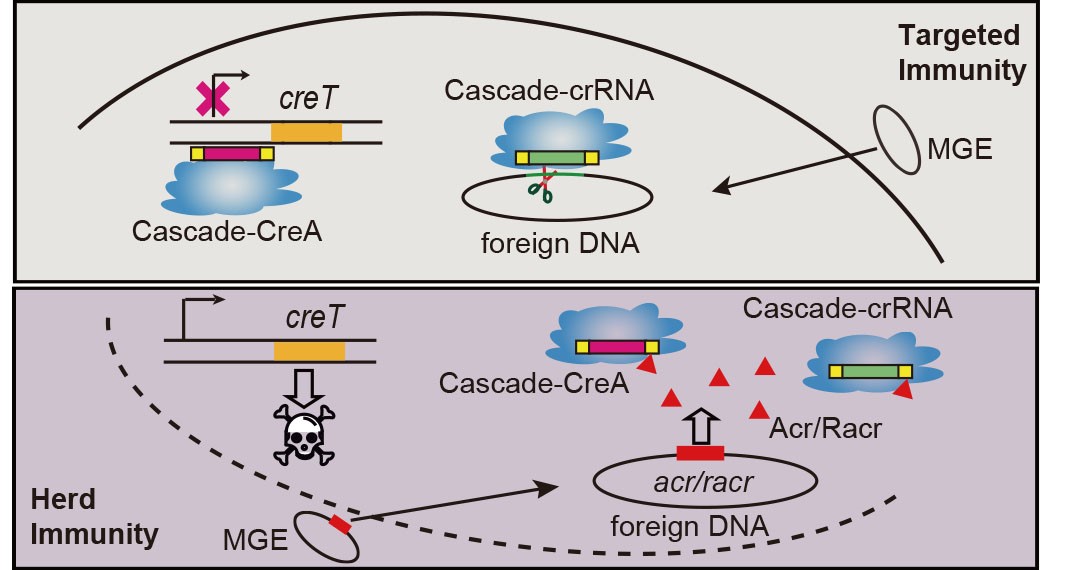
图1 CRISPR通过调控毒素表达对携带Acr的非靶标MGE产生群体免疫
原文链接:https://www.nature.com/articles/s41589-024-01693-3




