近日,中国科学院微生物研究所刘翠华团队联合汪静研究员、高福院士及首都医科大学逄宇教授共同揭示了结核病(tuberculosis,TB)的病原菌——结核分枝杆菌(M. tuberculosis,Mtb)慢性感染过程中由LILRB1–HLA-G信号轴驱动的自然杀伤(natural killer,NK)细胞免疫耗竭(immune exhaustion)的表型特征与调控机制,相关研究以“LILRB1–HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis”为题发表于EMBO Molecular Medicine。
Mtb等病原慢性感染诱发的抗原长期暴露或炎症持续刺激可能导致免疫细胞功能耗竭,此过程主要由免疫卡控点(immune checkpoint)异常表达而引起。固有免疫作为机体抵抗Mtb感染的首道防线,其在TB患者中多呈现免疫抑制状态并进而导致适应性免疫应答延迟及病原菌清除受阻,但调控固有免疫细胞抵抗Mtb感染的关键卡控点及作用机制尚不清楚,严重限制了靶向免疫卡控点的TB治疗策略的发展。
该研究聚焦固有免疫中可迅速响应感染并发挥杀伤活性以清除病原的NK细胞,通过整合质谱流式(CyTOF)技术与转录组测序,对Mtb感染不同阶段人群的NK细胞免疫表型与功能进行全面分析,鉴定发现NK细胞表面的抑制性受体LILRB1是一个关键的免疫卡控分子,可指征一群TB相关的具有功能耗竭表型的NK细胞亚群。机制研究表明,Mtb感染可诱导巨噬细胞表达并分泌人白细胞抗原HLA-G,进而诱导NK细胞表面LILRB1的表达上调并激活LILRB1下游的酪氨酸磷酸酶SHP1/2,后者进一步抑制MAPK信号通路的传导,最终损害NK细胞对Mtb感染的巨噬细胞的杀伤活性。在人源化小鼠模型中,利用封闭性抗体阻断LILRB1与HLA-G的结合可增强宿主NK细胞依赖的抗Mtb感染能力,提示LILRB1封闭性抗体可用于开发靶向宿主的TB免疫治疗新手段(图1)。
中国科学院微生物研究所汪静研究员、项目研究员柴琪瑶、博士生雷泽慧、硕士生王一如和何杰华为论文的共同一作,中国科学院微生物研究所刘翠华研究员、高福院士和北京胸科医院逄宇教授为论文的共同通讯作者。该研究得到了国家重点研发计划等项目的资助。
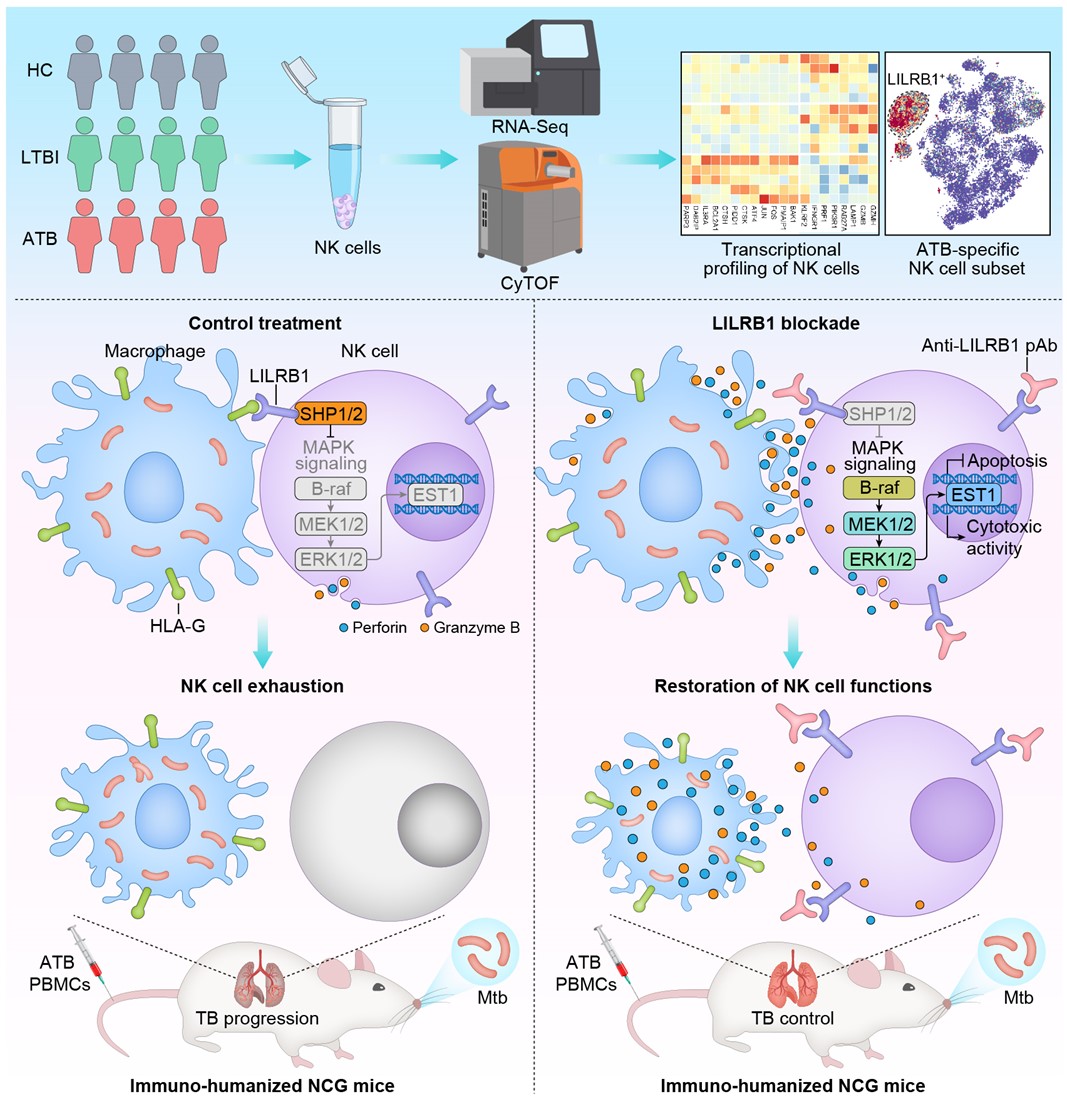
图1. 阻断LILRB1–HLA-G信号轴可逆转TB患者NK细胞抗Mtb免疫应答
文章链接:https://www.embopress.org/doi/full/10.1038/s44321-024-00106-1




