近日,微生物所王硕团队在肠道共生菌调控肠道免疫细胞表观遗传修饰方面取得进展,相关研究成果以“Microbiota regulates the TET1-mediated DNA hydroxymethylation program in innate lymphoid cell differentiation”为题发表在Nature Communications上。该研究系统揭示了固有淋巴细胞(ILC)及其前体细胞的DNA甲基化和羟甲基化修饰图谱,并揭示肠道菌群通过调控ILC的DNA甲基化修饰促进ILC分化的功能机制。
固有淋巴样细胞(ILC)在黏膜抗感染和维持组织稳态中发挥重要作用。然而,对于黏膜中ILC细胞及其前体细胞的DNA甲基化修饰以及调控机制研究甚少。王硕研究团队通过MeDIP/hMeDIP–seq系统分析了ILC及其前体细胞的DNA甲基化和羟甲基化图谱,并发现ILC前体细胞(ILCP)具有较高的DNA羟甲基化水平。研究团队通过构建羟甲基化酶TET1的条件性敲除小鼠模型,发现TET1缺失会导致I型固有淋巴细胞(ILC1)数量增加。通过机制研究发现,TET1可以通过促进Tgfbr1启动子羟甲基化,从而抑制ILCP向ILC1的分化。进一步研究发现,肠道菌群可以通过代谢物调控ILCP的DNA羟甲基化,从而促进ILC1的分化,在早期黏膜免疫系统建立过程中发挥了重要作用。综上,本研究揭示了ILC及其前体细胞的DNA甲基化图谱,并揭示了肠道菌群调控DNA甲基化和ILC分化的功能机制,为理解肠道共生菌与黏膜免疫系统功能建立的关系提供了理论依据。
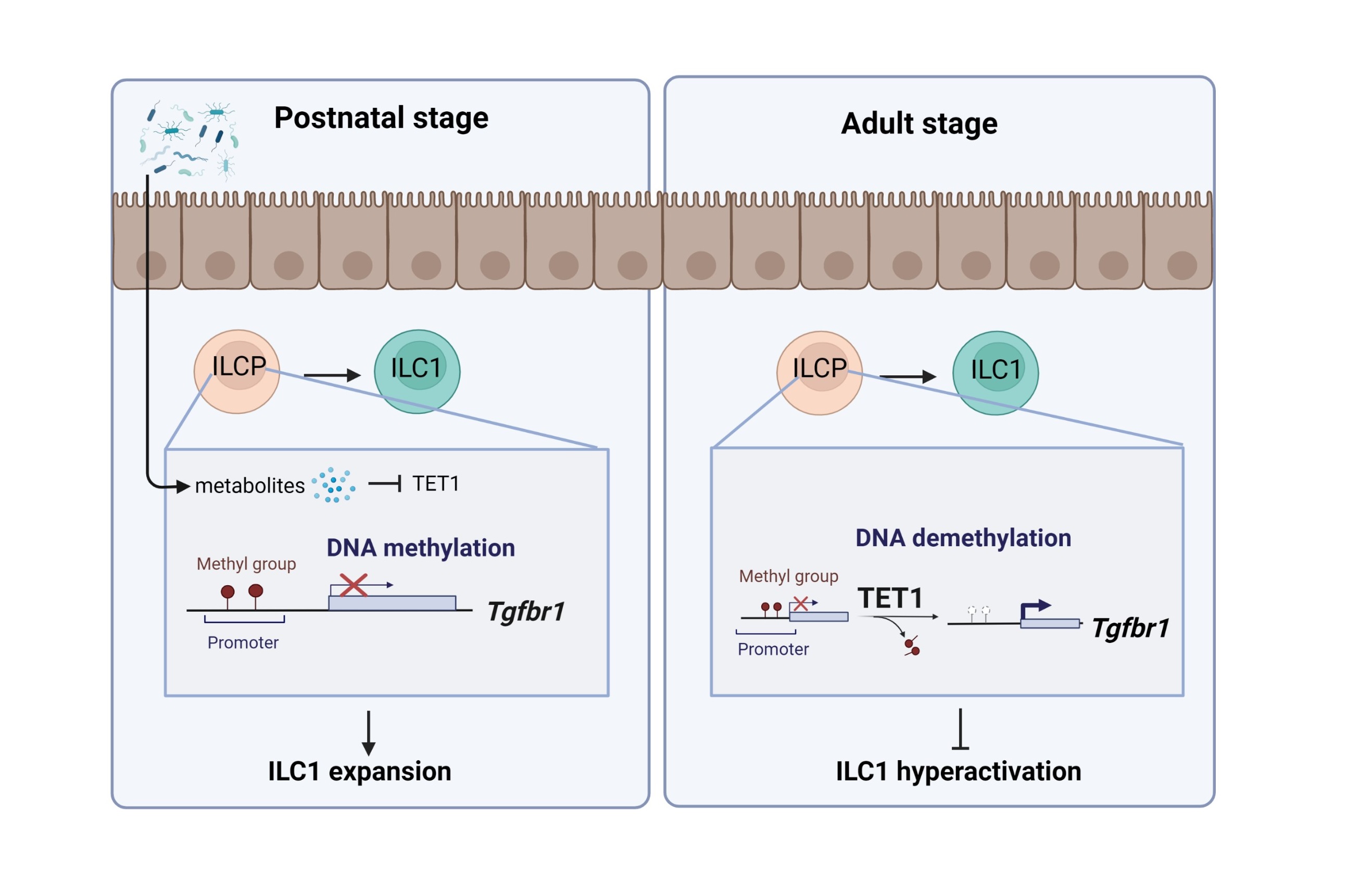
图1. 肠道菌群通过调控DNA甲基化促进ILC1分化示意图
中国科学院微生物研究所博士研究生张旭昇、硕士研究生高心潼和博士研究生刘臻为本文共同第一作者,中国科学院微生物研究所王硕研究员为本文通讯作者。该研究得到了中国科学院基础前沿科学研究计划从“0到1”原始创新项目、国家重点研发计划等项目的资助。
论文链接: https://www.nature.com/articles/s41467-024-48794-0




