近日,中国科学院微生物研究所王琳淇研究团队在Nature Microbiology上发表论文,题为Brain glucose induces tolerance of Cryptococcus neoformans to amphotericin B during meningitis。该研究发现了真菌耐药新类型—宿主驱动的表型耐药(host-induced antifungal tolerance),为真菌脑膜炎临床复发感染治疗提供了重要线索,并提出了针对性治疗策略。
真菌性脑膜炎是最危险的真菌感染疾病之一,新生隐球菌则是真菌性脑膜炎头号病原体。目前两性霉素B是治疗隐球菌脑膜炎唯一杀菌类药物(fungicidal drug),但其治疗失败和复发感染事件频繁发生,背后机制尚不明确。
团队系统评估了数百种宿主代谢物对两性霉素B杀菌效果的影响,发现脑部葡萄糖对于新生隐球菌耐受两性霉素B杀伤至关重要。团队同时解析了葡萄糖诱导隐球菌耐药性产生的机制,确定了关键调控因子,并证实了该调控因子介导的药物耐受显著降低了两性霉素B对隐球菌脑膜炎的治疗效果,促进了疾病复发。在此过程中,葡萄糖诱导了该调控因子从细胞质进入细胞核,从而发挥其调控功能,促进了磷酸肌醇神经酰胺合成,磷酸肌醇神经酰胺可与两性霉素B竞争其位于细胞膜上的靶点麦角甾醇,从而抑制两性霉素B与麦角甾醇的结合,导致药物耐受发生。金担子素是磷酸肌醇神经酰胺合成酶的抑制剂,且已被证明具有良好的宿主安全性。研究结果显示,金担子素与两性霉素B联合使用在动物模型中对隐球菌脑膜炎具有明显的治疗效果,其7天的治愈率明显优于临床推荐的两性霉素B-氟胞嘧啶治疗策略。
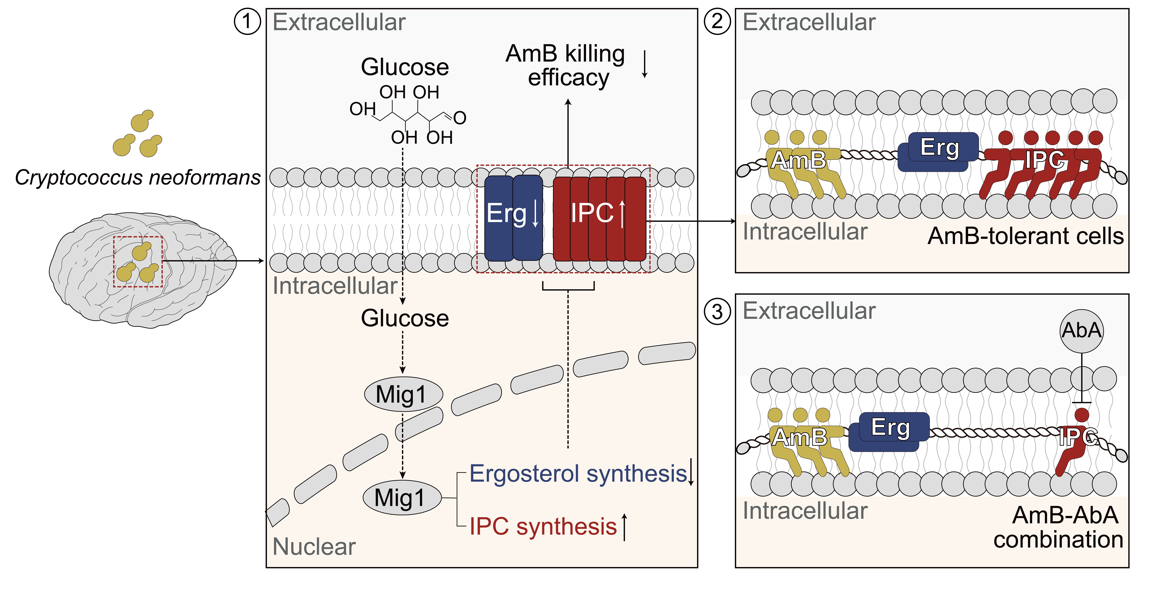
图1. 脑部葡萄糖诱导新生隐球菌表型耐药过程及针对性治疗策略示意图
中国科学院微生物研究所特别研究助理陈磊博士、副研究员田秀云和博士研究生张兰月为本文共同第一作者,中国科学院微生物研究所王琳淇研究员为本文通讯作者。研究得到了国家重点研发计划、国家自然科学基金委面上项目和中国科学院科技创新“交叉与合作团队”等项目支持。




