近日,中国科学院微生物研究所高福研究团队和王硕研究团队在Science Bulletin期刊发表题为“Spatially resolved transcriptomics reveals distinct pulmonary immune responses during influenza virus and SARS-CoV-2 infections”的研究论文。该研究比较了新冠病毒和流感病毒感染下的肺部黏膜免疫空间转录组特征,阐明了早期肺部呼吸道病毒引起的肺脏黏膜免疫动态应答过程,揭示了新冠感染早期B1细胞的活化特点及免疫保护作用,为深入理解呼吸道病毒感染的保护性应答机制及疫苗设计提供了理论依据。
流感病毒和SARS-CoV-2引起的呼吸道黏膜免疫应答对感染的控制和病原体的清除至关重要。目前对于SARS-CoV-2感染后肺部黏膜免疫应答的具体调控机制及其与流感病毒感染的区别尚不清楚。
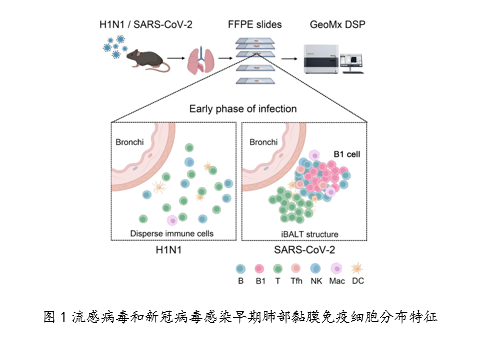
该研究通过空间转录组学研究了流感病毒和新冠病毒感染过程中肺部免疫应答的动态变化过程,分析了两种呼吸道病毒感染不同阶段,肺部区域免疫细胞的定位、类型和功能的转变。研究发现,相比于流感病毒感染,新冠病毒感染早期肺部黏膜会更快形成诱导性支气管相关淋巴组织(iBALT)结构并活化B1细胞产生较高水平IgM和IgA(图1)。同时,新冠病毒及表达其S蛋白的假病毒感染均能够诱导小鼠和人的B1细胞的活化,产生IgA。将表达新冠病毒S蛋白的腺病毒载体疫苗AdC7-S对小鼠进行滴鼻免疫后,可以成功诱导包含B1细胞的iBALT,并在抗呼吸道病毒感染中发挥广泛的保护作用。
中国科学院微生物研究所助理研究员赵敏、特别研究助理邵菲、博士研究生刘臻为论文共同第一作者,微生物所高福院士和王硕研究员为该论文共同通讯作者。本研究得到了国家自然科学基金项目和中国科学院稳定支持基础研究领域青年团队计划等项目的支持。