2023年9月1日,中国科学院微生物研究所李明和向华研究团队合作在Cell Host & Microbe期刊上发表题为“Widespread RNA-base cas regulation monitors crRNA abundance and anti-CRISPR proteins”的文章,揭示了CRISPR护卫RNA的全新生理功能。
细菌CRISPR-Cas免疫系统由CRISPR结构和Cas蛋白组成,而Cas蛋白的表达如何适应时刻变化的CRISPR结构和crRNA表达量是该领域长期悬而未决的基本科学问题。
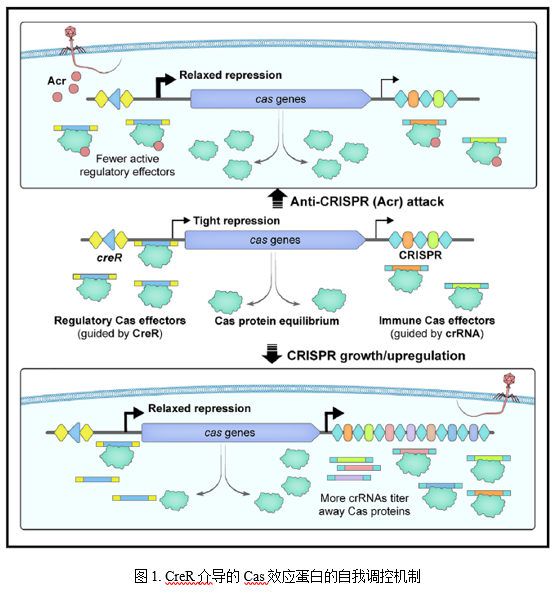
2021年,微生物所研究团队报道了CRISPR的护卫RNA元件即一对受CRISPR-Cas调控的双RNA型毒素-抗毒素系统,命名为CreTA (CRISPR-regulated toxin-antitoxin)(Science. 372(6541):eabe5601)。近期研究发现,抗毒素CreA不仅指导Cas蛋白抑制毒素creT基因的表达,使菌体细胞对Cas蛋白“成瘾”(一旦Cas蛋白被失活或抑制,毒素将表达杀死菌体),而且能够介导Cas蛋白的自抑制调控回路,从而有效避免Cas蛋白过度表达导致的能量负担和自免疫风险(靶向自身DNA)。通过生物信息学分析,团队发现CreA的类似分子(由于大多缺乏偶联的CreT毒素,因此称为Cas-regulating RNA,即CreR)广泛存在于Class 1和Class 2的CRISPR系统中(主要是I型和V-A型)。这些CreR(或CreA)分子介导的Cas蛋白自调控回路不仅可以感应胞内crRNA的浓度,实现两者的协调表达,而且能够有效感应噬菌体携带的anti-CRISPR(Acr)蛋白,从而快速激活Cas蛋白的高水平表达,以应对Acr的攻击。这一发现不仅从全新视角阐释了CRISPR-Cas如何协调crRNA和 Cas 蛋白的表达这一领域内基本科学问题,而且揭示了一种作用于转录水平的anti-anti-CRISPR新策略。
中国科学院微生物研究所博士研究生刘超、博士后王锐、程飞跃、舒宪和李洁副研究员为该论文的并列第一作者,李明研究员和向华研究员为该论文的共同通讯作者。该研究得到了国家自然科学基金、中国科学院战略性先导科技专项、中国科学院青年创新促进会和中国博士后科学基金等项目的经费支持。