近日,微生物研究所付钰研究团队在mBio期刊发表文章,题为“Single-molecule study reveals Hmo1, not Hho1, promotes chromatin assembly in budding yeast”,从单分子水平证明了酿酒酵母中是Hmo1蛋白而非Hho1蛋白在染色质组装中发挥重要功能。
长期以来,关于酿酒酵母中连接组蛋白H1的归属一直存在争议。付钰团队建立模拟酵母细胞核内生理环境的体外生化体系YNPE (Yeast Nucleoplasmic Extracts),结合单分子技术(全内反射荧光显微技术和磁镊),从显微成像和力学操纵两个角度,揭示了是Hmo1蛋白而非Hho1蛋白直接参与酿酒酵母中的染色质组装;Hmo1可促进YNPE体系中的核小体组装以及核小体链的进一步折叠压缩;Hmo1富含赖氨酸的C端结构域是其染色质压缩的关键功能结构域,而Hho1蛋白C末端的第二个球形结构域影响了其压缩功能。此外,本研究发现,与人组蛋白H1类似,Hmo1可与dsDNA形成相分离现象;且Hmo1在细胞周期中的磷酸化修饰程度与后生生物连接组蛋白H1的细胞周期变化趋势高度一致。本研究为明确酿酒酵母中真正的连接组蛋白H1提供了关键证据,为连接组蛋白H1在真核生物中的进化和多样性提供了新见解。
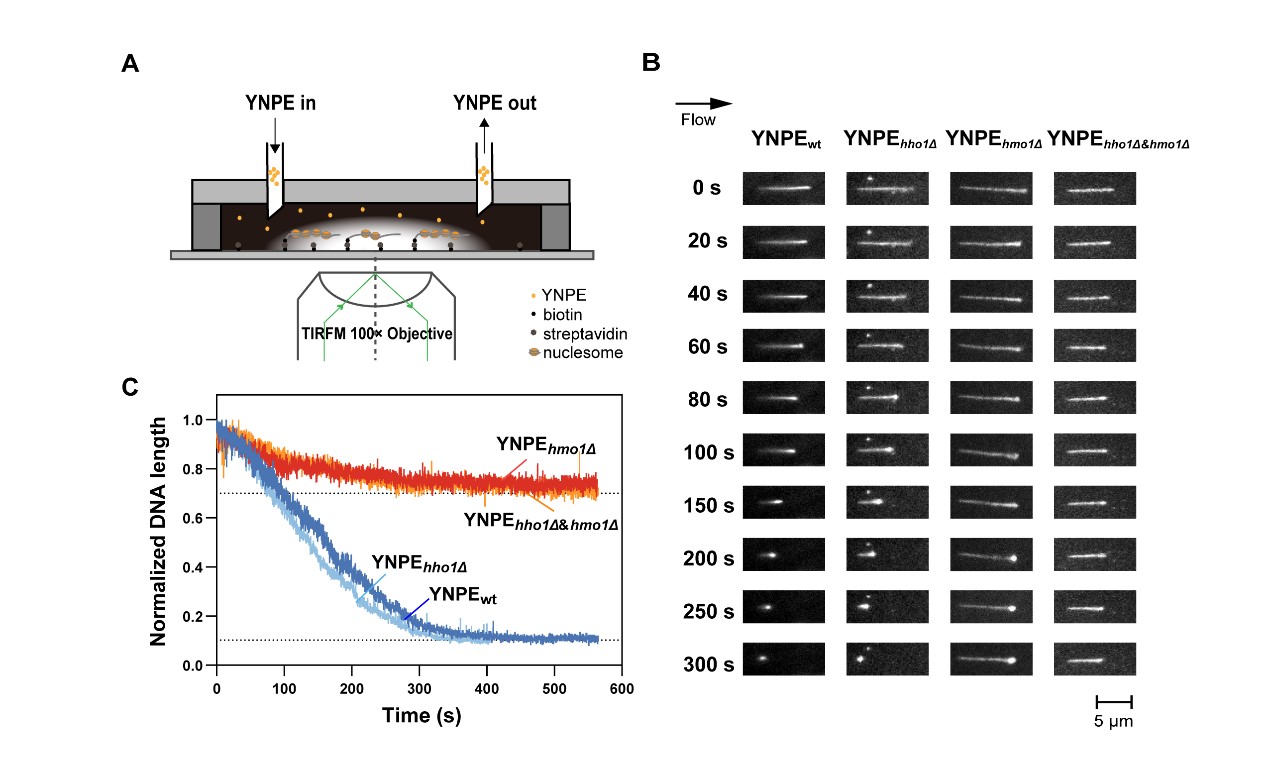
图1 YNPE结合全内反射荧光显微技术表明Hmo1在酿酒酵母染色质组装中发挥重要作用
中国科学院微生物所博士研究生王梦雪为文章第一作者,付钰研究员为通讯作者。本项研究工作得到了国家自然科学基金(31970553)、国家重点研发计划等项目的资助。




