近期,微生物所刘翠华研究团队和军事科学院军事医学研究院张令强研究团队合作,在Cell Reports发表了题为“A Golgi-resident GPR108 cooperates with E3 ubiquitin ligase Smurf1 to suppress antiviral innate immunity”的文章,揭示了高尔基体定位蛋白GPR108与E3泛素连接酶Smurf1协同抑制抗病毒固有免疫的新机制(图1)。
多种重要的膜性细胞器,如高尔基体、内体、内质网、线粒体和过氧化物酶体等,在抗病毒免疫反应中都发挥着重要的调控作用。高尔基体作为聚糖和脂质合成、蛋白质翻译后修饰以及囊泡运输的枢纽,对维持细胞稳态至关重要,但其在抗病毒免疫反应中的作用及精细调控机制仍不清楚。
研究人员筛选了预测的59个高尔基体定位蛋白,发现GPR108在病毒感染后表达显著上调,提示GPR108在病毒感染过程中可能具有重要的调控功能。GPR108敲除细胞实验结果证明了GPR108能抑制病毒感染诱导的I型干扰素反应。进一步的机制探寻发现,病毒感染能诱导GPR108与E3泛素连接酶Smurf1的C2结构域结合,进而解除Smurf1同源二聚体介导的自抑制并激活Smurf1。激活的Smurf1通过促进磷酸化IRF3的K63泛素化修饰而促进其与自噬受体NDP52的结合,最终促进IRF3的自噬降解。研究人员还通过小鼠病毒感染模型进一步证实GPR108能抑制抗病毒固有免疫反应。
该研究揭示了高尔基体定位蛋白GPR108抑制抗病毒固有免疫反应的新机制。这一发现为深入了解高尔基体在抗病毒免疫反应中的精细调控机制提供了新见解,同时提示GPR108-Smurf1轴可能是缓解抗病毒免疫反应中过度炎症导致的组织病理损伤的潜在干预新靶点。
中科院微生物所硕士研究生赵梦圆和客座研究生张勇为该论文的共同第一作者,中科院微生物所刘翠华研究员和军事科学院军事医学研究院、国家蛋白质科学中心(北京)张令强研究员为本文的共同通讯作者。该研究得到了国家重点研发计划项目、国家自然科学基金委、中国科学院战略性先导科技专项(B类)和蛋白质组学国家重点实验室自主课题基金项目的资助。
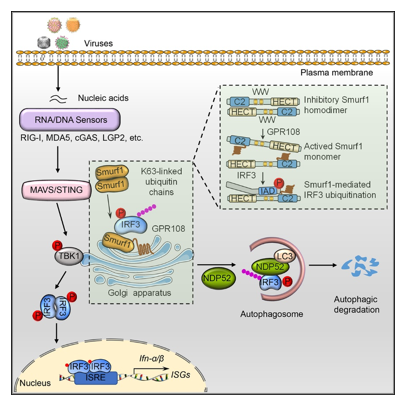
图1. 高尔基体定位蛋白GPR108协同泛素连接酶Smurf1抑制抗病毒免疫
文章链接:https://www.sciencedirect.com/science/article/pii/S2211124723006666




