炎症是机体对病原微生物、有害刺激物或物理伤害所产生的防御反应。适度的炎症有利于清除病原微生物和修复受损组织,但过度的炎症会导致进一步的组织受损甚至危害生命。炎症一般可分为炎症激活、炎症消退以及组织修复、稳态重构三个阶段,细胞因子、趋化因子等炎性介质在炎症的不同阶段发挥着不同的作用。IL-1β是典型的促炎细胞因子,其表达受到双信号的严格控制。起始信号可以诱导无生物活性pro-IL-1β的表达,激活信号则能够激活炎症小体,随后成熟的Caspase-1将 pro-IL-1β切割成有生物活性的IL-1β并分泌到细胞外发挥作用。
Cyclophilin A(CypA)是一种在各种组织中广泛存在的肽基脯氨酰顺反异构酶。该团队十多年来对CypA进行了系统性的研究,发现CypA参与流感病毒复制、抗病毒天然免疫及流感病毒继发的细菌共感染(Cellular Microbiology, 2009;Cell Reports, 2021)。而且,CypA能够通过调控RIG-I/MAVS/NF-κB(eLife,2017)信号通路和IL-6反式信号通路(FESAB J,2021)促进IL-1β等炎症因子的表达,但CypA在炎症的不同阶段发挥怎样的作用仍然未知。此次研究就CypA在炎症激活、炎症消退以及组织修复过程中的作用及其作用机制进行了深入探讨。
该研究利用野生型和CypA敲除小鼠构建了LPS诱导急性肺炎的模型,分析CypA在炎症不同阶段的作用。结果显示,CypA在炎症早期能够促进炎症,而在炎症后期却发挥了抑制炎症的作用,这与CypA调控的IL-1β的产生密切相关。在炎症激活阶段,CypA增强Smurf1介导的pro-IL-1β的K63连接泛素化,进而有利于IL-1β的成熟。而在炎症消退阶段,CypA增强Smurf1介导的pro-IL-1β的K48连接泛素化及蛋白酶体途径降解。成熟的IL-1β与其受体结合后激活NF-κB、c-Jun等转录因子,触发炎症级联反应。研究人员进一步构建了IL-1β诱导急性肺炎的小鼠模型,发现CypA能够增强IL-1β、IL-6、TNF-α等细胞因子的表达,加重肺组织损伤。同时,CypA抑制Cyld介导的ILK去K63连接泛素化,从而正调控IL-1β/ILK/AKT信号通路,促进肺上皮细胞间质化介导的肺纤维化修复。综上,CypA通过增强IL-1β的表达和成熟促进炎症的激活和肺损伤,随后通过增强IL-1β的降解和IL-1β诱导的上皮细胞间质化促进炎症的消退和肺组织修复。
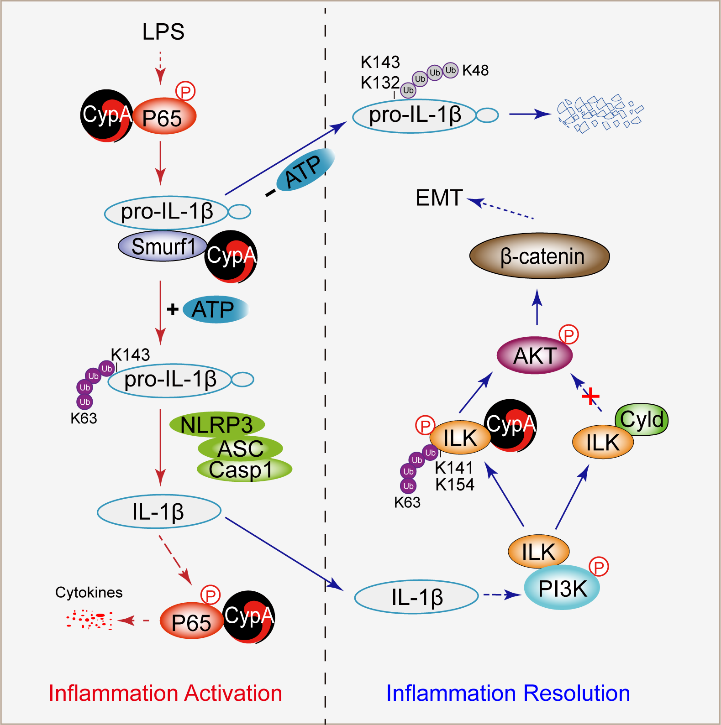
CypA在炎症不同阶段对IL-1β介导炎症的精确调控模式图
该研究揭示了CypA在炎症不同阶段对IL-1β介导炎症的调控机制,有助于深入理解炎症反应的复杂且精细的调控过程,并为抗炎症药物研究及IL-1β相关的炎症和肿瘤等疾病的治疗提供了重要理论支撑。
以上研究发表在Cell Reports期刊上,题为“Delicate regulation of IL-1β-mediated inflammation by cyclophilin A”。中国科学院微生物研究所杨文贤博士为论文第一作者,孙蕾项目研究员、刘文军研究员为论文共同通讯作者。该研究得到中国科学院战略性先导科技专项(B类)、国家自然科学基金委等资助。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00249-2




