目前,一些细胞(如Vero、VeroE6等)和动物模型(hACE2转基因小鼠、叙利亚黄金地鼠、雪貂、非人类灵长类动物等)常被用作新冠病毒(SARS-CoV-2)感染模型,但这些细胞系和动物模型并不能精准模拟人体的生理特征,且所用的动物模型仅表现出轻到中度的感染症状,一定程度限制了药物和疫苗真实有效性的测试。因此,迫切需要能够更好地模拟人体病理生理状态的研究模型。
近期,中国科学院微生物研究所毕玉海研究员团队分别与清华大学陈晔光院士团队、中国农业大学吴森教授团队合作,建立了人远端支气管类器官和新冠病毒受体hACE2转基因猪模型,为SARS-CoV-2/COVID-19发病机制的深入研究、精准治疗、疫苗和药物有效性及安全性测试提供了新的可靠的感染模型。
研究者从远端肺组织中培养生成人类远端支气管类器官(hDBOs),通过免疫荧光方法在这一模型中鉴定出6种细胞类型,分别为基底细胞、纤毛细胞、棒状细胞、AT1细胞、AT2细胞和杯状细胞,发现SARS-CoV-2可以感染这6种细胞类型。hDBOs感染SARS-CoV-2后,出现的病理变化与COVID-19患者的临床特征相似。对感染病毒后的hDBOs进行转录组学分析,发现一系列细胞反应:病毒感染早期角质化基因下调,随后发生从氧化磷酸化向糖酵解的代谢转换,脂肪酸代谢减少,内质网应激,细胞周期阻滞,凋亡以及溶酶体功能下降(图1)。清华大学王婷博士研究生、中科院微生物所张宁博士等为本研究论文第一作者,北京大学第三医院马少华副主任医师、中科院微生物所毕玉海研究员、清华大学陈晔光院士为通讯作者,中科院高福院士为共同作者。
hACE2人源化猪模型是通过位点特异性敲入人ACE2(hACE2)取代猪的ACE2所建立的新冠肺炎猪模型。在猪内源性ACE2启动子的调控下,几乎在所有组织中(脑组织除外)都有高表达hACE2,从肺和肾中分离出来的原代上皮细胞对SARS-CoV-2高度敏感,并表现出明显的细胞病变效应和对病毒N蛋白的免疫荧光信号(图2)。中国农业大学杜旭光副教授、郭紫航博士,中科院微生物所范文辉博士等为本研究论文第一作者,中科院微生物所刘文军研究员为共同作者,中国农业大学吴森教授、中科院动物所余大为博士和中科院微生物所毕玉海研究员为通讯作者。
上述研究均发表在Cell Discovery杂志。研究得到了国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项和中科院青年创新促进会等项目的支持。
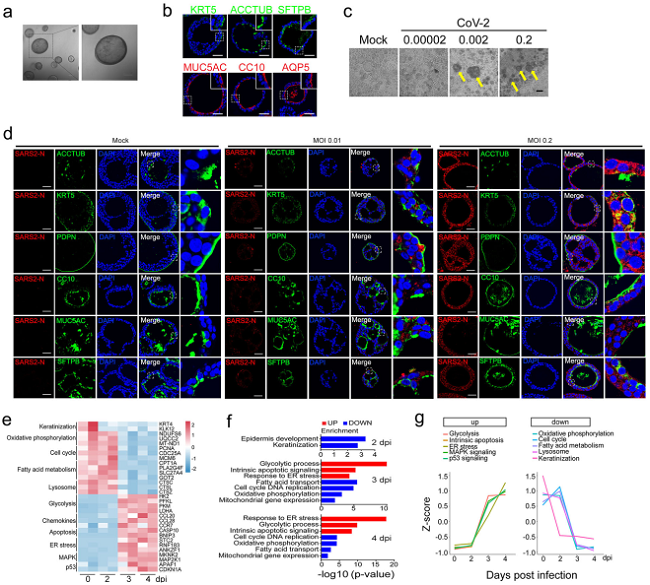
图1.人远端支气管类器官感染模型建立及其感染组学研究结果
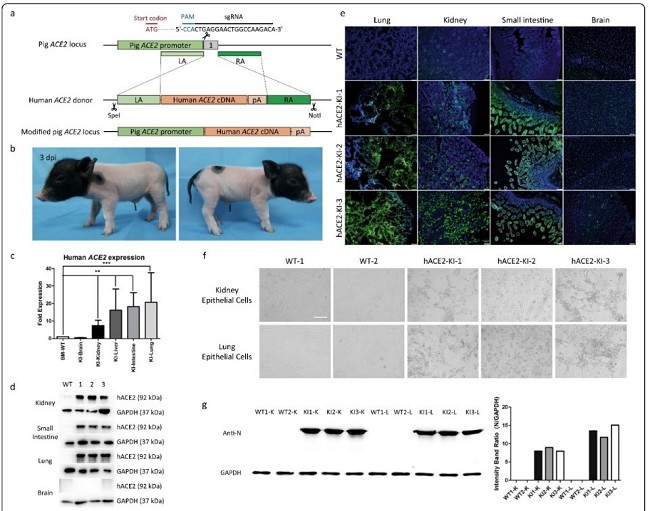
图2.hACE2人源化猪模型的构建及其细胞对SARS-CoV-2的敏感性研究结果
论文链接:
https://www.nature.com/articles/s41421-021-00346-2
https://www.nature.com/articles/s41421-021-00313-x




