结核病(Tuberculosis, TB)是由结核分枝杆菌(M. tuberculosis, Mtb)感染引起的重要的致死性慢性传染病。2019年全球约有1000万新发TB患者,约有140万人死于TB。Mtb是一种非常成功的胞内寄生病原菌,能够利用一系列效应蛋白调控宿主的免疫功能,进而实现其感染、存活、致病和传播。中国科学院微生物研究所刘翠华课题组长期致力于Mtb等重要病原菌与宿主互作机制方面的研究,近年来先后在Nature Immunology、Nature Communication、Proc Natl Acad Sci、EMBO reports、Cellular & Molecular Immunology等杂志发表系列研究工作,揭示了Mtb效应蛋白与宿主间动态博弈的过程及分子机理,为抗结核治疗及新药研发提供了基于病原-宿主互作界面的新思路和潜在新靶点。
Mtb编码一系列真核样激酶家族蛋白,其中真核样丝氨酸/苏氨酸蛋白激酶PknG可分泌至宿主细胞内,且与Mtb的胞内存活及致病过程密切相关,因而是潜在的抗结核药物理想靶标。刘翠华课题组最近报道了PknG可作为一种全新的泛素修饰酶,通过非经典的两步级联反应催化宿主底物的泛素化修饰进而促进其通过蛋白酶体降解,最终抑制宿主NF-κB固有免疫信号通路的激活并促进Mtb的胞内存活过程(EMBO reports, 2021)。近日,刘翠华课题组进一步揭示了PknG干扰宿主固有免疫应答的又一重要新机制:即PknG通过其不同结构域或其激酶活性作用于宿主自噬过程的多个阶段,最终阻断自噬流并促进病原菌的胞内存活。一方面,Mtb PknG通过其C端结构域竞争性结合丝氨酸/苏氨酸蛋白激酶AKT的PH(pleckstrin homology)结构域从而抑制AKT的活化并诱导自噬的发生。另一方面,PknG通过其TPR结构域直接结合小GTP酶RAB14,同时利用其激酶活性催化RAB14的活化蛋白AS160(GTPase-activating proteins, GAP)的磷酸化,从而阻抑RAB14-GTP水解成RAB14-GDP,使RAB14处于持续激活状态,进而抑制自噬体与晚期内体及溶酶体的融合,最终阻断自噬流并抑制自噬介导的病原菌清除过程。
本研究的关键创新点和科学意义为:1)发现了Mtb中首个通过多节点调控宿主自噬流的Mtb效应蛋白PknG,揭示了Mtb寄居于细胞内新“避所”(未成熟自噬体)的免疫逃逸新策略;2)阐明了Mtb 直接结合并抑制宿主AKT的激酶活性进而诱导自噬发生的新机制,增进了对PI3K-AKT-MTOR通路及磷脂酰肌醇在病原-宿主互作界面的关键调控作用的认识; 3)鉴定了PknG在宿主细胞内的新型激酶底物AS160,并进一步揭示了其靶向宿主RAB14的双重调控机制:结合RAB14并阻断与其结合的GTP水解,磷酸化AS160进而抑制其针对RAB14的GAP活性。
综上,本研究的创新性成果阐释了Mtb PknG通过多节点调控宿主自噬流的全景图,提供了抗结核治疗的潜在新靶点及精准策略,即促进PknG的C端结构域与AKT互作进而促进自噬的发生,同时通过特异性靶向PknG的激酶活性及PknG-RAB14互作界面从而解除对自噬流的阻断作用,最终促进异源自噬介导的病原清除作用(图1)。
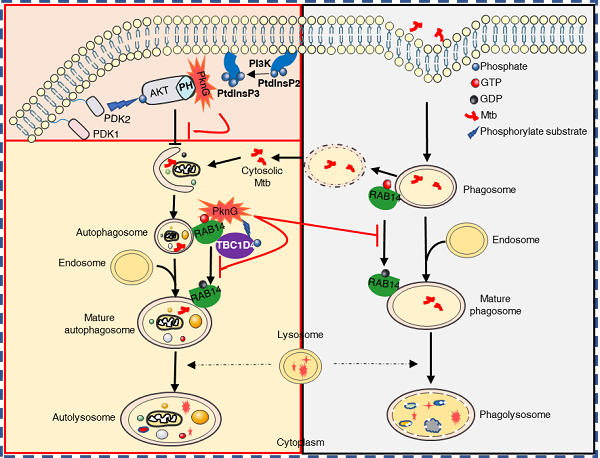
图1 Mtb PknG在多节点调控宿主自噬流进而阻断异源自噬介导的病原菌清除过程的模式图
相关研究结果已在线发表于国际权威期刊Autophagy上,题为“M. tuberculosis PknG manipulates host autophagy flux to promote pathogen intracellular survival”。刘翠华课题组的博士研究生葛浦浦和硕士研究生雷泽慧为该论文的共同第一作者,中国科学院微生物所的汪静项目研究员和刘翠华研究员为本文的共同通讯作者。该研究得到国家自然科学基金委、中国科学院战略性先导科技专项(B类)、国家重点研发计划项目、国家科技重大专项和中国科学院青年创新促进会人才项目的资助。
文章链接:https://doi.org/10.1080/15548627.2021.1938912




