塑料工业已逐渐发展为国民经济的支柱产业,在给人类社会的生活、生产带来方便的同时,也导致大量的废旧塑料垃圾不断产生。由于其固有的硬度、强度、耐用性及稳定性需求,废弃塑料制品无法自动降解,长期暴露对环境造成严重危害。目前塑料垃圾的处理方式通常是填埋和焚烧,这种“生产-废弃-处理”的单向过程既不符合循环经济的理念,也无法从源头解决“白色污染”问题。
2004年,英国普利茅斯大学的 Richard C. Thompson 等人在《Science》杂志发表短文,提出了“微塑料”的概念。大量不可降解的微小塑料碎片(~20 μm)在环境中逐步转移到土壤和海洋,最终进入生态圈和食物链,被包括人类在内的生物摄入,威胁人类健康和动植物的生存,发展绿色生物降解策略已成为生态、环境等领域发展的迫切需求。2016年,日本京都工艺纤维大学的Kohei Oda团队在《Science》杂志报道了首个可以在30oC下可有效降解低结晶度PET塑料的IsPETase降解酶。然而,该酶稳定性极差,并不能满足生物降解实际应用需求。
近日,中国科学院微生物研究所的吴边团队提出了一种提出新型蛋白质稳定性计算设计策略(greedy accumulated strategy for protein engineering, GRAPE)(图1),基于计算机蛋白质设计对IsPETase进行了稳定性改造,获得了鲁棒性显著增强的重设计酶,为拓宽生物降解塑料的应用场景提供了新思路。
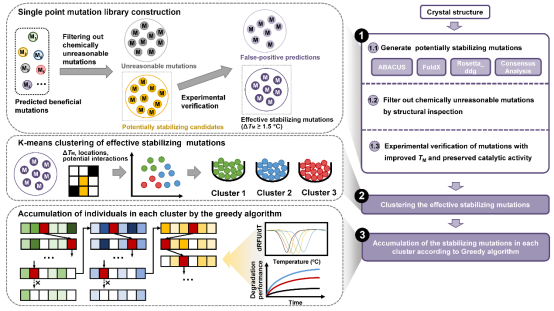
图1. GRAPE 策略示意图
该团队首先采用融合策略,综合使用四种不同的单点预测算法辅以结构缺陷分析,预测了85个潜在有益突变。随后,他们对预测突变进行了实验检验,获得了21个有益单点突变(ΔTm ≥1.5°C)。通过K-means聚类算法,作者将21个有益单点突变分为3个Cluster,并依据贪婪算法(图2)对每个Cluster进行迭代叠加。
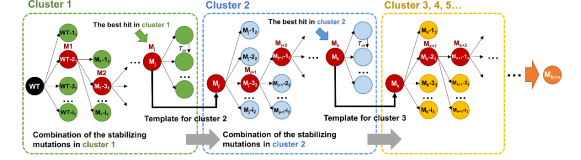
图2. 贪婪算法示意图
经过10轮迭代叠加,作者成功获得熔融温度提高31°C的IsPETase突变体(命名为DuraPETase)。在温和条件下,DuraPETase对30%结晶度PET薄膜的降解效率相较于野生型提升了300倍(图3B)。通过扫描电镜可观察到,经DuraPETase处理后的PET薄膜内部结构发生了显著的腐蚀变化(图3D)。
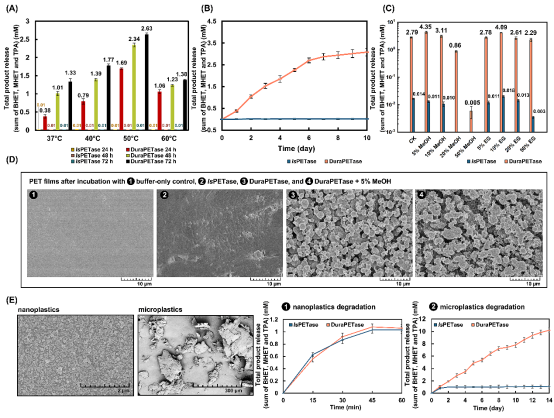

随后,作者对DuraPETase蛋白晶体结构进行解析(图4),验证了突变体活性位点区域氨基酸之间协同相互作用,探究了DuraPETase性能改善的分子机制。值得注意的是,该项研究实现了2 g/L微塑料在温和条件下的完全降解,为废水中微塑料的预处理提供新的处理思路。
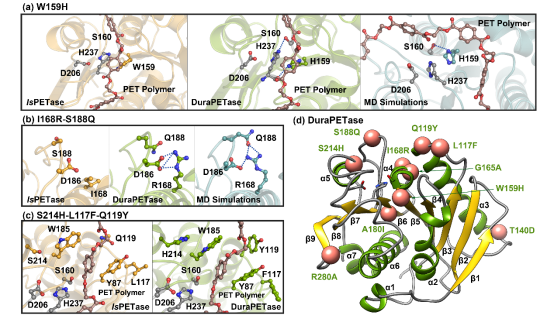
图4.(a)W159H,(b)I168R-S188Q,及(c)S214H-L117F-Q119Y突变的结构分析,黄色、绿色、蓝色分别代表野生型IsPETase,DuraPETase晶体结构及DuraPETase的分子动力学模拟轨迹构象
GRAPE策略的优势在于运用聚类算法和贪婪算法,对计算获得的有益突变体进行系统聚类分析再结合贪婪算法进行网络迭代叠加,大幅规避了不同突变位点间的负协同相互作用,在较短时间内最大限度的探索序列空间叠加路径。该项研究为计算机辅助蛋白质改造提供了新思路,也为进一步了解和推进自然环境中的聚酯水解提供了有价值的工具。近期这一成果发表在《ACS Catalysis》杂志上,并被评选为当期封面文章。中国科学院微生物研究所助理研究员崔颖璐及博士研究生陈艳春为论文共同第一作者,吴边研究员为通讯作者。微生物研究所向华研究员、唐双焱研究员、杜文斌研究员;天津工业生物技术研究所刘卫东团队;中科大刘海燕团队;南京大学梁勇团队以及加州大学Houk教授为该工作的完成提供了重要的指导与帮助。
该研究得到了国家自然科学基金委员会与欧盟合作项目《合成塑料降解转化微生物菌群》、国家重点研发计划、国家自然科学基金优秀青年项目和面上项目、中国科学院战略生物资源服务网络计划生物资源衍生库项目、以及北京市自然科学基金项目的支持,并获得了诺维信公司的宝贵技术支持和帮助。
文章链接:https://pubs.acs.org/doi/10.1021/acscatal.0c05126




