链霉菌以能够产量丰富的次级代谢产物而著称,这些次级代谢产物是微生物药物的重要来源。然而,链霉菌在长期的进化中获得合成次级代谢产物的能力,只是为了更好的生存(如与其它微生物竞争营养物质等资源),并不是生来就是人们理想的“药物生产工厂”。因此,要实现链霉菌为我所用的目标,就必须深入解析影响这些代谢产物产生的共性规律,进而在认知的基础上改造链霉菌代谢途径,获得高效链霉菌微生物细胞工厂。
聚酮类药物是链霉菌产生的一类重要次级代谢产物,其生物合成过程受到严谨的控制,只有在发酵进入稳定期才大量合成。稳定期由于营养限制,表现为菌体停止生长,胞内初级代谢物浓度显著降低。然而聚酮合成的前体是初级代谢的中间代谢物,此时浓度降低的这些中间代谢物如何满足聚酮大量合成的实际需求? 另外,除了直接来自初级代谢途径,还有没有其它胞内代谢途径也参与并贡献了聚酮合成?我们又如何理性的控制这些相关代谢途径,使聚酮类药物更高效的合成?中科院微生物研究所王为善项目研究员(青促会员)与华东理工大学张立新教授、中国农业科学院植物保护研究所向文胜教授等国内外9家单位,对这一系列未解之谜进行探索(图1a)。
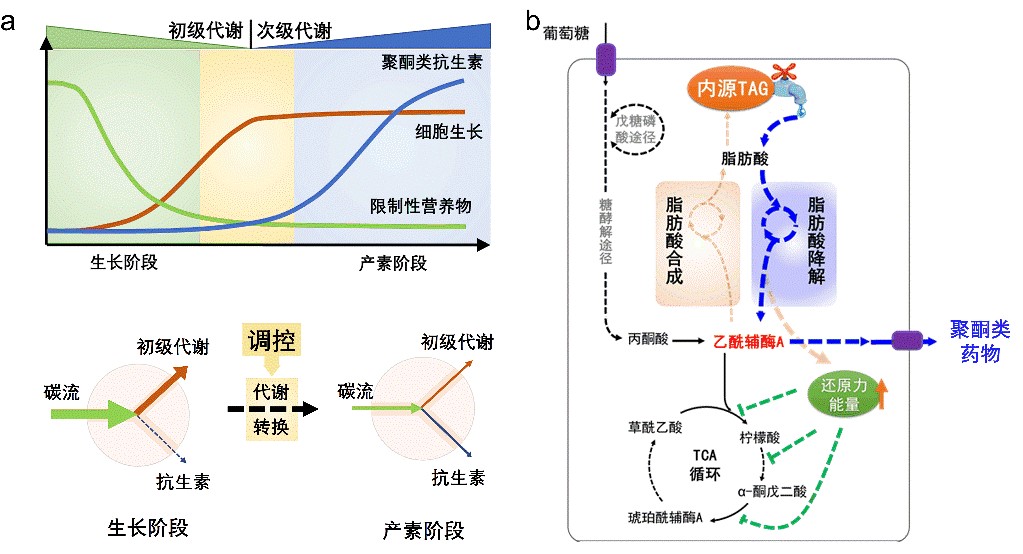
图1:链霉菌内源三酰甘油(TAG)在衔接初级代谢和次级代谢、调节代谢转换中的关键作用(a);基于调控TAG建立的次级代谢产物高产策略(b)
他们通过一系列组学分析和实验验证,清晰的阐明了链霉菌内源三酰甘油(TAGs)在衔接初级代谢和聚酮类次级代谢产物合成过程中起的关键作用:在生长阶段,链霉菌在生长的同时还积累内源TAGs;当菌体停止生长,进入稳定期,内源TAGs则开始降解。内源TAGs的降解不但为聚酮类次级代谢产物的合成提供前体和还原力,还能够通过还原力水平变化,使菌体细胞中更多的碳流流向聚酮类次级代谢产物的合成。在这一认知的启发下,研究团队建立了通过“适时”、“适量”的控制内源TAGs的降解来提高链霉菌聚酮类药物产量的工程策略,显著提高了阿维菌素等重要聚酮类药物的产量。这一工作于19年12月09号发表在Nat. Biotechnol.杂志(DOI:10.1038/s41587-019-0335-4)。审稿人评价道:这是70年来首次在代谢水平清晰阐明链霉菌初级代谢到次级代谢的代谢转换机制并进行工程应用(This is a fascinating discovery. To my knowledge this link has never been established in the 70 years since the use of polyketides as antibiotics and other drugs began……)。无独有偶,与他们发现的链霉菌代谢转换机制类似,美国Hal Alper教授也在Metab. Eng.杂志同时发表文章(DOI:10.1016/j.ymben.2019.11.006),报道了在解脂耶氏酵母菌中控制内源TAGs的降解能够有效提高III型聚酮类代谢产物的产量。
反观聚酮类药物的工业发酵,不难发现,一些被驯化的高产菌种同样需要用到含有豆油的培养基才能够实现产量的大幅提升(如盐霉素、四环素和红霉素生产菌的发酵)。这一研究为深度揭示链霉菌中TAGs降解和聚酮类药物合成的代谢机制,进而充分利用内源、外源TAGs,实现高效、智能的聚酮类药物生物智造开辟了新思路。
在原核微生物中,只有链霉菌属、分支杆菌属、红球菌属等少数种属进化出合成内源TAGs的能力。这一研究也为深入认识自然生境中链霉菌积累内源TAGs的生物学意义打开了新的视角。




