生命在于运动,免疫在于平衡。一个健康的个体体内的免疫细胞足以消灭体内不断出现的病变细胞,这其中就包括一些可能会发生癌变的细胞。T细胞是机体所有抗肿瘤免疫体系的主力军,而肿瘤往往能够逃逸机体的免疫监视,让我们的T细胞对肿瘤细胞“视而不见”,甚至有时候肿瘤细胞近在眼前,却又对它无能为力,只能“袖手旁观”。T细胞的活性很大程度上受到“阴”“阳”两类分子的调节,也就是抑制型和激活型“免疫检查点”分子。在CTLA-4和PD-1对T细胞负调控机制研究和应用方面做出开创性贡献的美国科学家James Allison和日本科学家Tasuku Honjo共同获得了2018年诺贝尔生理学或医学奖。
4-1BB(CD137)是T细胞表面一种重要的激活型免疫检查点分子,属于肿瘤坏死因子受体家族分子(TNFR),含有4-1BB信号的嵌合抗原工程化T细胞(CAR-T)被广泛应用于各种靶点细胞治疗的研究和临床应用当中。不仅如此,目前已经有多种4-1BB激活型抗体进入临床研究阶段,包括百时美施贵宝公司(Bristol-Myers Squibb)的urelumab 抗体和辉瑞公司(Pfizer)的utomilumab 抗体,这些抗体单独或与其它肿瘤治疗方法联合使用,能够显著提高肿瘤治疗效率。因此,对4-1BB与其配体及激活型抗体作用机制的研究,不仅能够阐明其激活机制,而且对于4-1BB为靶点的肿瘤免疫治疗性药物的开发具有重要价值。
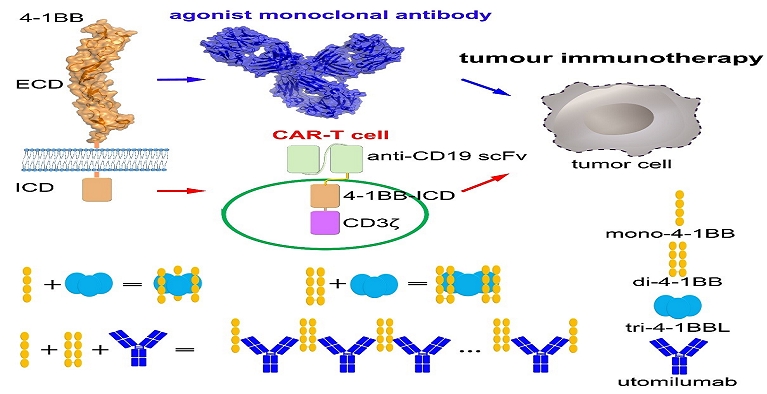
图1. 4-1BB分子在肿瘤抗体药物开发及CAR-T细胞治疗中具有重要应用价值
最近,《Cell Reports》杂志报道了微生物所高福院士和田波院士团队联合苏州医工所高山研究员关于4-1BB与配体及激活型抗体作用机制的重要研究成果。
研究团队发现,4-1BB 与4-1BBL 作用模式属于经典的TNF-TNFR结合模式,4-1BBL 以三聚体的形式结合三个4-1BB 单体分子(mono-4-1BB),表明单体形式的4-1BB与配体结合模式的保守性。对4-1BB激活型抗体utomilumab结合机制的分析发现,4-1BB的配体(4-1BBL)与激活型抗体utomilumab 结合4-1BB 的表位存在一定程度的重叠,而进一步通过流式细胞术与Octet分子相互作用分析实验的验证,进一步表明二者结合4-1BB 时存在显著的竞争关系,提示在utomilumab的作用过程中会阻断4-1BBL介导的4-1BB活化信号。
通过对活化的T 细胞进行检测,发现T细胞能够表达单体(mono-4-1BB)和二体 (di-4-1BB) 两种形式的4-1BB分子,并对两种不同形式的4-1BB分子,尤其是di-4-1BB与配体作用的结合模式进行了研究。研究表明4-1BBL 结合T 细胞表面的4-1BB 后不会对4-1BB产生广泛交联,并过度激活下游信号。文章提出了4-1BB结合配体及激活型抗体的作用模式,指出配体和激活型抗体介导的4-1BB交联受到其独特的结合模式的调控,且T细胞表面mono-4-1BB 和di-4-1BB分子的比例也是其信号活化重要调节因素 (图1)。
文章对4-1BB与其配体和激活型抗体作用模式的阐明,对于理解4-1BB分子活化的分子基础及激活型抗体的作用机制具有重要意义。同时,该研究对于开发以4-1BB为代表的激活型免疫检查点抗体药物提供了重要的理论基础。
中国科学院微生物研究所李燕,谭曙光和苏州医工所张常为论文共同第一作者,中国科学院微生物研究所高福和田波院士以及苏州医工所高山研究员为论文共同通讯作者。本研究得到了国家自然科学基金和中国科学院战略性先导科技专项项目的经费支持。
近年来,该团队在免疫检查点抗体药物作用机制方面开展了系列研究工作,在PD-1, PD-L1及CTLA-4等靶点抗体药物的结合机制,PD-1糖基化修饰对抗体药物影响等方面取得了重要进展,相继发表在《Nature Communications》《Cell Research》《Protein Cell》等,为相关靶点药物开发提供了重要的理论依据。
参考文献:
Li Y#, Tan S#, Zhang C#, Chai Y, He M, Zhang C. W., Wang Q, Tong Z, Liu K, Lei Y, Liu W, Liu Y, Tian Z, Cao X, Yan J, Qi, J, Tien P*, Gao S*, Gao G.F.* Limited cross-linking of 4-1BB by 4-1BB ligand and the agonist monoclonal antibody utomilumab. Cell Rep. 2018. Oct 23;25(4):909-920.e4.
Tan S#, Zhang H#, Chai Y#, Song H, Tong Z, Wang Q, Qi J, Wong G, Zhu X, Liu WJ, Gao S, Wang Z, Shi Y, Yang F, Gao GF*, Yan J*. An unexpected N-terminal loop in PD-1 dominates binding by nivolumab. Nat Commun.2017 Feb 6;8:14369.
Liu K#, Tan S#, Chai Y, Chen D, Song H, Zhang CW, Shi Y, Liu J, Tan W, Lyu J, Gao S, Yan J, Qi J*, Gao GF*. Structural basis of anti-PD-L1 monoclonal antibody avelumab for tumor therapy. Cell Res 2017 Jan; 27(1):151-153.
Tan S#, Liu K#, Chai Y, Zhang C. W.-H. Gao S, Gao G.F., Qi J.* Distinct PD-L1 binding characteristics of therapeutic monoclonal antibody durvalumab. Protein Cell. 2018 Jan; 9(1): 135–139.
He M#, Chai Y#, Qi J, Zhang C. W.-H., Tong Z, Shi Y, Yan J, Tan S* and Gao G.F.* Remarkably similar CTLA-4 binding properties of therapeutic ipilimumab and tremelizumab antibodies. Oncotarget. 2017. 8:67129-67139.
Tan S, Chen D, Liu K, He M, Song H, Shi Y, Liu J, Zhang C. W.-H., Qi J, Yan J, Gao S*, Gao G.F.* Crystal clear: visualizing the intervention mechanism of the PD-1/PD-L1 interaction by two cancer therapeutic monoclonal antibodies. Protein Cell. 2016 Dec;7(12):866-877
Tan S, Zhang C. W-H., Gao GF*. Seeing is believing: anti-PD-1/PD-L1 monoclonal antibodies in action for checkpoint blockade tumor immunotherapy. Signal Transduct Target Ther. 2016 Nov 25;1:16029.




