2024年8月23日,中国科学院微生物研究所向华团队在Nature Communications 发表论文,题为“Engineered minimal type I CRISPR-Cas system for transcriptional activation and base editing in human cells”。团队应用Class 1中最精简的I-F2型系统在人类细胞中实现了高效基因调控,并开发了具有宽编辑窗口的碱基编辑工具。
I型CRISPR-Cas系统属于Class 1,是自然界分布最广泛的CRISPR-Cas系统,包括7种亚型(I-A到I-G)。基于I型系统开发的遗传工具在其宿主原核生物中表现出高效性与适应性,但由于其效应物Cascade通常由至少4种亚基组成,Cas3基因也很大,其基因之和远大于目前通用的Class 2中Ⅱ型Cas9和V型Cas12(Cpf1)等工具系统,不利于临床递送等问题,限制了I型系统在真核细胞中的开发与应用。因此,进一步发现最精简的I型CRISPR-Cas系统,创建新的基因操作工具平台,实现真核生物细胞基因调控与编辑,是突破Cas9和Cas12等基因编辑底层技术限制的重要途径。
团队研究发现,来自奥斯陆莫拉氏菌(Moraxella osloensis CCUG 350)的精简型I-F2型系统,其Cascade(Cas5-6-7)基因大小之和约2.7kb, 小于SpCas9(约4.1kb),通过融合不同的功能结构域可以在人类细胞中实现高效的转录激活或宽窗口的碱基编辑。在转录调控方面,I-F2 CRISPRa具有强可塑性,可以通过改变spacer长度实现不同转录水平的精细调控。在碱基编辑方面,I-F2 ABE能产生独特的宽编辑窗口,具有更多的可靶向位点,能诱导更多的突变类型。这项研究突出最精简的I-F2型系统在真核生物中的应用潜力,不仅有望实现单个AAV递送,其宽窗口的碱基编辑工具还适用于功能序列的破坏,如作物育种中重要基因的原位饱和诱变与多重碱基编辑等。而I-F2型系统的多亚基结构,还有望为开发更多新颖的基因操作工具提供底层平台。
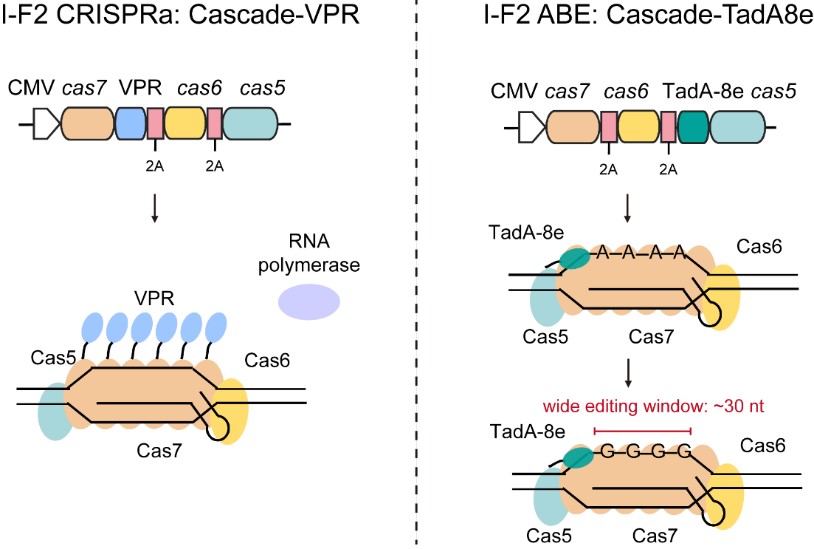
图1. I-F2型系统可提供多样性基因操作工具的底层平台
中国科学院微生物研究所博士研究生郭京、特别研究助理龚路遥和工程师禹海英为该论文的并列第一作者,向华研究员和龚路遥博士为该论文共同通讯作者。该研究得到了中国科学院战略性先导科技专项、国家自然科学基金和国家重点研发计划等项目的支持。
原文链接:https://www.nature.com/articles/s41467-024-51695-x
 附件下载:
附件下载:
信息