作者利用前期开发的NabLC技术构建了MUC高产菌,通过体内、体外实验证明了muc BGC通过形成内酰胺键产生吡咯烷-2,4-二酮环的机制(图1)。通过生物信息学分析,发现含muc样BGC的菌株大部分与人类密切相关,其中人类和动物分离株大多保留了mucF,可能产生MUC应对宿主免疫压力;发酵食品、植物分离株大多缺乏mucF,可能主要产生reutericyclins(RTCs,抗菌)用于竞争(图2)。此外,MucF同源蛋白广泛存在于人体微生物中,且大部分菌株都不含muc样BGC(图3)。来源于斯卡多维亚菌等口腔常见菌和戈登链球菌等变形链球菌竞争菌中的MucF同源蛋白都能将RTCs转化为MUC。
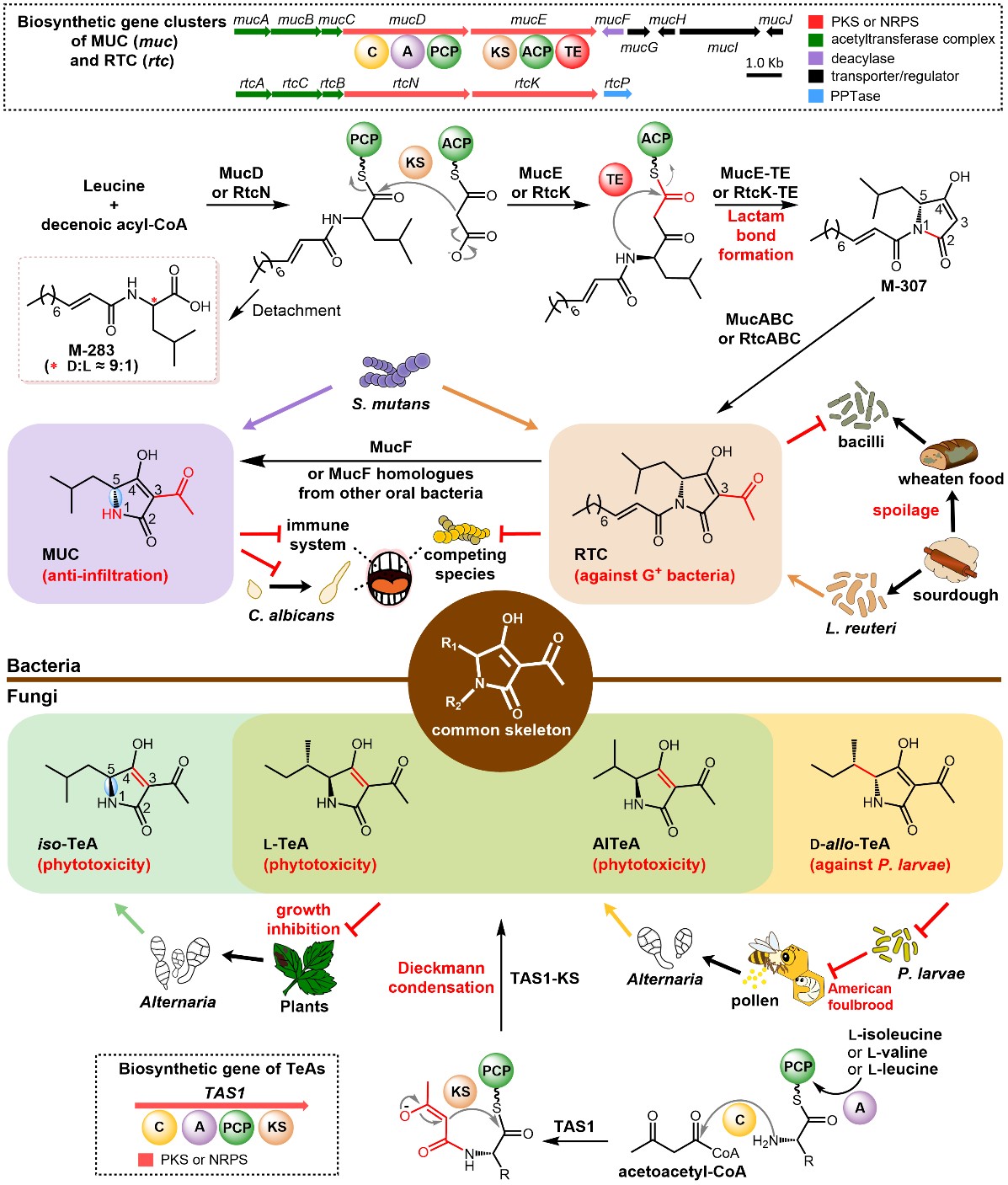
图1 MUC,RTCs和TeAs的生物合成机制及其在宿主中的生态作用
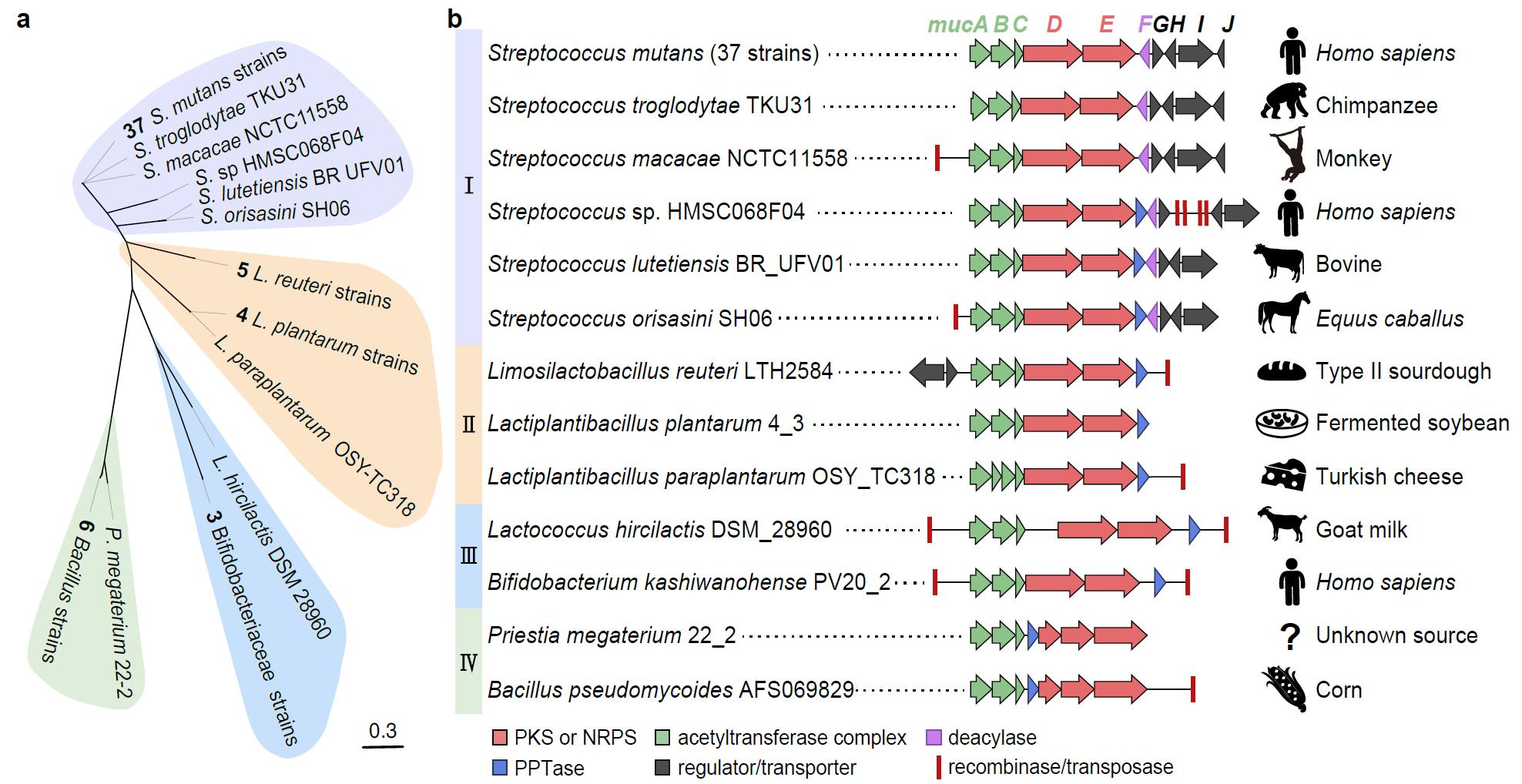
图2 muc样BGC的系统发育分析、结构和分布
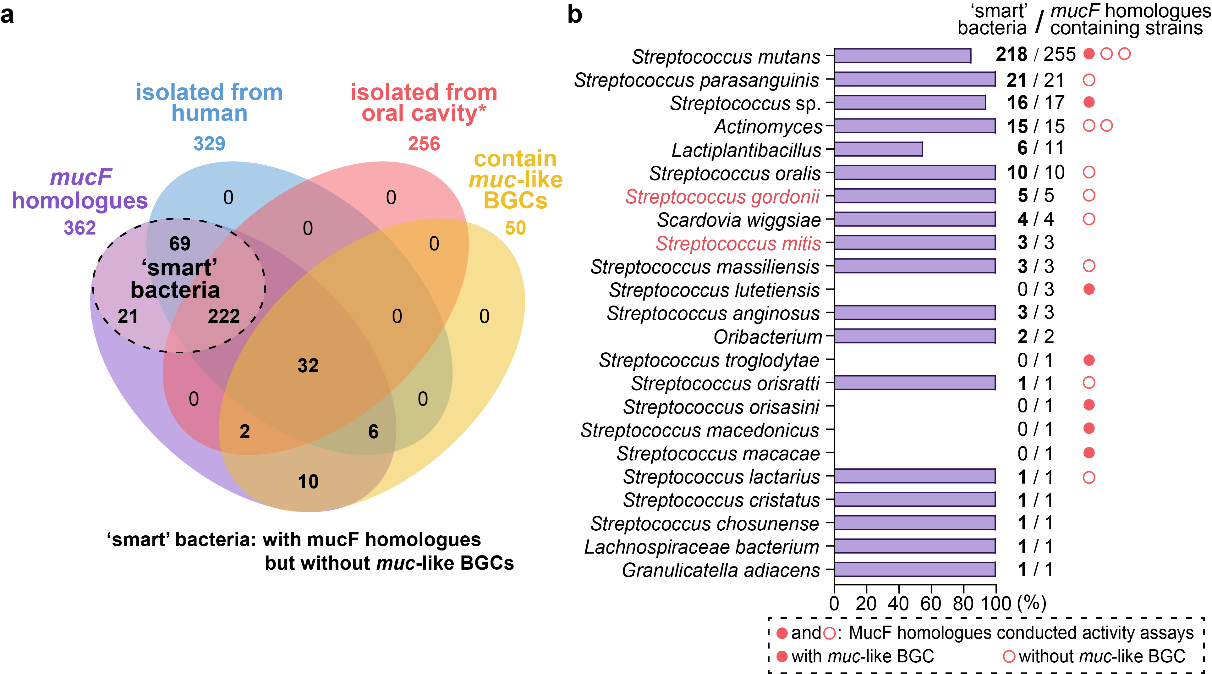
图3 本研究中发现的MucF同源蛋白的分布
本研究证明了muc BGC产生Tetramates(TA)类化合物的特殊机制。由于MUC和RTCs中3-乙酰化修饰发生在环化后,这一机制可能存在于更多C-3位无修饰的TA类化合物中。muc样BGC主要存在于人类相关微生物中,很多同生境微生物获得了MucF同源蛋白来发挥“解毒”功能。MUC、RTCs和TeAs(tenuazonic acids,植物毒性)展示了细菌、真菌在长期进化过程中通过不同机制产生了相同骨架的化合物,并巧妙地通过细微变化丰富了化合物结构和功能。
陈义华研究组博士生张雨薇,已毕业研究生王敏、张昭以及唐啸宇研究组博士生廖格为本文共同第一作者,陈义华研究员和唐啸宇研究员为共同通讯作者。该研究工作得到了科技部重点研发计划、国家自然科学基金委杰出青年基金项目、广东省“珠江人才计划”、 深圳湾实验室启动基金等项目支持。北京大学口腔医学院王衣祥研究员、夏斌教授及微生物所冯婕研究员为本工作提供了重要帮助。
全文链接:https://doi.org/10.1186/s40168-023-01548-4
 附件下载:
附件下载:
信息