组长:王奇慧研究员、副所长

研究方向
重要囊膜病毒的入侵机制、宿主抗体应答规律以及干预手段的设计和开发
研究内容及意义
近年来重要囊膜病毒,如新冠病毒(SARS-CoV-2)、中东呼吸综合征冠状病毒(MERS-CoV)、重症急性呼吸综合征冠状病毒(SARS-CoV)、寨卡病毒等,引起的新发突发传染病疫情频发,直接威胁公共健康与国家安全,造成了重大的经济损失,亟需以基础研究为指导,开发出高效的疫苗和药物,尤其是广谱的疫苗与广谱药物。在病毒与宿主的相互作用过程中,囊膜病毒首先通过表面糖蛋白与宿主细胞上特定的受体识别和结合,这一步在一定程度上决定了病毒的跨种传播和致病机制。同时囊膜病毒与宿主受体的作用界面也是干预病毒感染的重要靶点。宿主产生的中和抗体即是通过结合囊膜蛋白,阻断病毒与受体的结合从而抑制病毒感染。因此,课题组聚焦可引发重大传染性疾病的囊膜病毒:
1)以病毒入侵机制的研究为基础,深度解析病毒进入细胞的全过程,精确锁定影响病毒入侵的关键靶点;
2)结合单细胞测序、生物信息学分析等手段,系统阐明宿主的抗体应答规律,建立抗体表位与功能知识图谱,精准识别病毒的广谱干预靶点,研究过程中获得的高效中和抗体可继续开发,为治疗病毒感染提供候选药物;
3)通过以结构为基础的理性设计,强化广谱干预靶点,辅以mRNA疫苗等技术,在动物感染模型上,进行免疫原性、预防和保护效果的评估,为疾病防控提供候选疫苗。
研究组长
研究组长:王奇慧
电话:010-64806927
电子邮箱:wangqihui#im.ac.cn(请将#替换成@)
通讯地址:北京市朝阳区北辰西路1号院3号
邮政编码:100101
主要学习及工作经历
2020.10-至今 中国科学院微生物研究所 研究员
2019.11-2020.10 中国科学院微生物研究所 项目研究员
2015.9-2019.11 中国科学院微生物研究所 副研究员
2017.9-2018.10 美国UTHealth at Houston 博士后、访问学者
2014.7-2015.9 中国科学院微生物研究所 助理研究员
2012.2-2014.7 中国科学院微生物研究所 博士后
2006.9-2012.1 中国科学院生物物理研究所/细胞生物学 博士研究生
2004.9-2005.9 山东大学/生物工程 第二校园
2002.9-2006.7 哈尔滨工业大学/生物工程 学士
获奖情况
1. 第十届“树兰医学青年奖”,2023年
2. 首届北京市先进科技工作者,2023年
3. 国家杰出青年科学基金,2022年
4. 第一届中国科学院青年五四奖章,2022年
5. 2021年度中国科学院青年科学家奖,2021年
6. 全国科技系统抗击新冠肺炎疫情先进个人,2021年
7. 第十四届吴孟超医学青年基金奖,2021年
8. 第十四届谈家桢生命科学创新奖,2021年
研究团队

- 工作人员
杜 沛 博士 副研究员(2020-)
胡新玲 博士 助理研究员(2022-)
仵丽丽 博士 助理研究员(2023-)
田晓东 博士 博士后(2022-)
李轶群 博士 博士后(2024-)
龚明丽 博士 博士后(2024-)
- 在读研究生
王晓云 博士生(2023-)
于淑帆 博士生(2023-)
赵润初 博士生(2024-)
刘 伟 博士生(2024-)
刘汉昭 直博生(2024-)
李睿琦 硕士生(2021-)
樊新元 硕士生(2022-)
冯英浩 硕士生(2022-)
郭雨欣 硕士生(2022-)
张晏宁 硕士生(2023-)
范 睿 硕士生(2023-)
路 彬 硕士生(2023-)
魏明晴 硕士生(2024-)
郭宇腾 硕士生(2024-)
- 联合培养学生
陈 茜 澳门大学联培博士生(2022-)
张 熠 安徽大学联培硕士生(2022-)
王春梅 云南大学联培硕士生(2022-)
李佳婧 温州医科大学联培硕士生(2023-)
代表性论文
1. Kong T#, Du P#, Ma R#, Wang H#, Ma X, Lu J, Gao Z, Qi H, Li R, Zhang H, Xia F, Liu Y, Wang R, Duan K, Wang Z, Wang Q*, Gao GF*. Single-chain A35R-M1R-B6R trivalent mRNA vaccines protect mice against both mpox virus and vaccinia virus. EBioMedicine. 2024, 109:105392.
2. Zhao R#, Wu L#, Sun J#, Liu D#, Han P, Gao Y, Zhang Y, Xu Y, Qu X, Wang H, Chai Y, Chen Z, Gao GF, Wang Q*. Two noncompeting human neutralizing antibodies targeting MPXV B6 show protective effects against orthopoxvirus infections. Nat Commun. 2024, 15(1): 4660.
3. Hu S#, Wu C#, Wu X#, Ma X, Shu C, Chen Q, Zheng A, Yang H, Lu J*, Du P*, Gao GF*, Wang Q*. Classification of five SARS-CoV-2 serotypes based on RBD antigenicities. Sci Bull (Beijing). 2023, 68(23): 3003-3012.
4. Wu L#, Zheng A#, Tang Y#, Chai Y#, Chen J, Cheng L, Hu Y, Qu J, Lei W, Liu WJ, Wu G, Zeng S, Yang H*, Wang Q*, Gao GF*. A pan-coronavirus peptide inhibitor prevents SARS-CoV-2 infection in mice by intranasal delivery. Sci China Life Sci. 2023, 66(10): 2201-2213.
5. Liu H#, Wu L#, Liu B#, Xu K#, Lei W#, Deng J#, Rong X, Du P, Wang L, Wang D, Zhang X, Su C, Fan Z, Bi Y, Chen H, Liu WJ, Qi J, Cui Q, Qi S, Fan R*, Jiang J*, Wu G*, Gao GF*, Wang Q*. Two pan-SARS-CoV-2 nanobodies and their multivalent derivatives effectively prevent Omicron infections in mice. Cell Rep Med. 2023, 4(2): 100918.
6. Huang M#, Wu L#, Zheng A#, Xie Y#, He Q#, Rong X, Han P, Du P, Han P, Zhang Z, Zhao R, Jia Y, Li L, Bai B, Hu Z, Hu S, Niu S, Hu Y, Liu H, Liu B, Cui K, Li W, Zhao X, Liu K, Qi J*, Wang Q*, Gao GF*. Atlas of currently-available human neutralizing antibodies against SARS-CoV-2 and escape by Omicron sub-variants BA.1/BA.1.1/BA.2/BA.3. Immunity. 2022, 55(8):1501-1514.
7. Zheng A#, Wu L#, Ma R#, Han P#, Huang B, Qiao C, Wang Q*, Tan W*, Gao GF*, Han P*. A binding-enhanced but enzymatic activity-eliminated human ACE2 efficiently neutralizes SARS-CoV-2 variants. Signal Transduct Target Ther. 2022, 7(1):10.
8. Niu S#, Wang J#, Bai B, Wu L, Zheng A, Chen Q, Du P, Han P, Zhang Y, Jia Y, Qiao C, Qi J, Tian W*, Wang H*, Wang Q*, Gao GF*. Molecular basis of cross-species ACE2 interactions with SARS-CoV-2-like viruses of pangolin origin. EMBO J (Cover story). 2021, 40(16): e107786.
9. Liu K#, Pan X#, Li L#, Yu F#, Zheng A, Du P, Han P, Meng Y, Zhang Y, Wu L, Chen Q, Song C, Jia Y, Niu S, Lu D, Qiao C, Chen Z, Ma D, Ma X, Tan S, Zhao X, Qi J*, Gao GF*, Wang Q*. Binding and molecular basis of the bat coronavirus RaTG13 virus to ACE2 in humans and other species. Cell. 2021, 184(13): 3438-3451.e10.
10. Liu K#, Tan S#, Niu S#, Wang J#, Wu L, Sun H, Zhang Y, Pan x, Qu X, Meng Y, Jia Y, Chen Q, Deng C, Yan J, Wang H-W, Wang Q*, Qi J*, Gao GF*. Cross-species recognition of SARS-CoV-2 to bat ACE2. Proc Natl Acad Sci U S A. 2021, 118(1): e2020216118.
11. Wu L#, Chen Q#, Liu K#, Wang J#, Han P, Zhang Y, Hu Y, Meng Y, Pan X, Qiao C, Tian S, Du P, Song H, Shi W, Qi J, Wang HW*, Yan J*, George, F. G, Wang Q*. Broad host range of SARS-CoV-2 and the molecular basis for SARS-CoV-2 binding to cat ACE2. Cell Discov. 2020, 6: 68.
12. Sun H#, Li Y#, Liu P#, Qiao C, Wang X, Wu L, Liu K, Hu Y, Su C, Tan S, Zou S, Wu G*, Yan J, Gao GF, Qi J* and Wang Q*. Structural basis of HCoV-19 fusion core and an effective inhibition peptide against virus entry. Emerg Microbes Infect. 2020, 9(1): 1238-1241.
13. Shi R#, Shan C#, Duan X#, Chen Z#, Liu P#, Song J#, Song T, Bi X, Han C, Wu L, Gao G, Hu X, Zhang Y, Tong Z, Huang W, Liu WJ, Wu G, Zhang B, Wang L, Qi J, Feng H, Wang FS*, Wang Q*, Gao GF*, Yuan Z* and Yan J*. A human neutralizing antibody targets the receptor binding site of SARS-CoV-2. Nature. 2020, 584(7819): 120-124.
14. Wang Q#, Zhang Y#, Wu L#, Niu S#, Song C#, Zhang Z, Lu G, Qiao C, Hu Y, Yuen K-Y, Wang QS, Zhou H, Yan J* and Qi J*. Structural and functional basis of SARS-CoV-2 entry by using human ACE2. Cell. 2020, 181(4): 894-904.e9.
15. Wang Q*#, Song H#, Cheng H, Qi J, Nam G, Tan S, Wang J, Fang M, Shi Y, Tian Z, Cao X, An Z, Yan J, Gao GF*. Structures of the four Ig-like domain LILRB2 and the four-domain LILRB1 and HLA-G1 complex. Cell Mol Immunol. 2020, 17(9) 966-975.
16. Wang Q#, Ma T#, Wu Y#, Chen Z#, Zeng H, Tong Z, Gao F, Qi J, Zhao Z, Chai Y, Yang H, Wong G, Bi Y, Wu L, Shi R, Yang M, Song J, Jiang H, An Z, Wang J, Yilma TD, Shi Y, Liu WJ, Liang M, Qin C, Gao GF*, Yan J*. Neutralization mechanism of human monoclonal antibodies against Rift Valley fever virus. Nat Microbiol. 2019, 4(7): 1231-1241.
研究中代表性图片
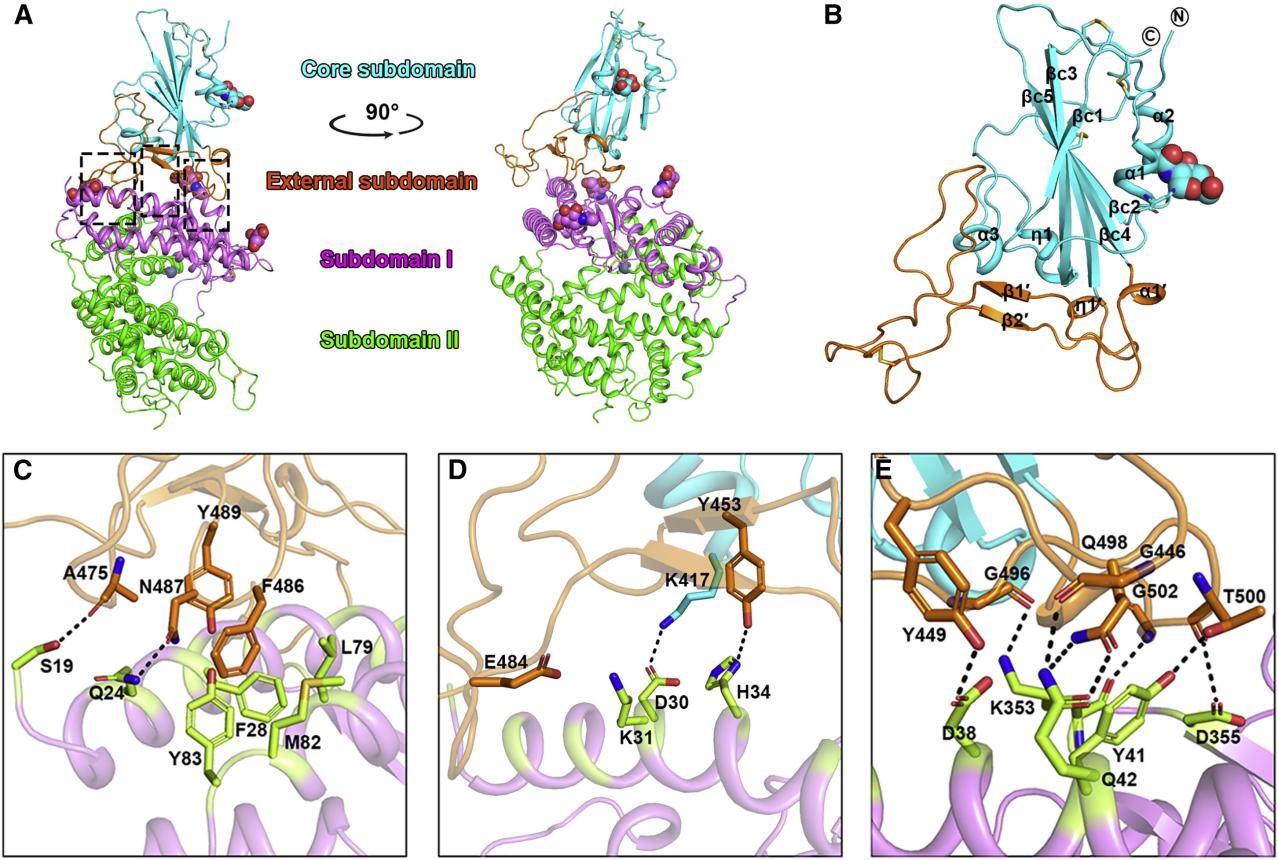
HCoV-19 RBD结合受体ACE2的整体结构与分子作用网络
代表性授权专利
1. 痘病毒多抗原嵌合疫苗及其用途(发明专利),授权号:ZL202211537702.4
2. 新冠病毒嵌合核酸疫苗及其用途(发明专利),授权号:ZL202210515599.7
3. 一株羊驼源纳米抗体及其应用(发明专利),授权号:ZL202210759496.5
4. 一种裂谷热病毒人源单克隆抗体及其应用(发明专利),授权号:ZL202210037887.6
5. 一种抗新型冠状病毒的多肽及其应用(发明专利),授权号:ZL202110939740.1
6. 新型冠状病毒的人源单克隆抗体及其应用(发明专利),授权号:ZL202110202604.4
7. 黄热病毒抗体及其应用(发明专利),授权号:ZL202110955389.5
8. 一种呼吸道合胞病毒的人源单克隆抗体及其应用(发明专利),授权号:ZL202110653393.6
参编专著
1. 《时不我待——追踪致命病毒的精彩人生》主译,中国科学技术出版社,2021年第一版
2. 《寨卡病毒与寨卡病毒病》第十六章,人民卫生出版社,2019年第一版
3. 《中东呼吸综合征公众防护问答》,科学普及出版社,2015年第一版




